Скорость химических реакций.
Факторы влияющие на скорость реакции.
Цель урока: раскрыть сущность понятия «скорость химических реакций», выявить
Зависимость скорости реакции от природы реагирующих веществ, их концентрации, площади соприкосновения, температуры, давления и наличия катализатора.
Задачи.
*Образовательные: формировать представления учащихся о скорости химических
реакций, содействовать расширению и развитию знаний о фак-
торах, влияющих на скорость химических реакций.
*Развивающие: продолжить развитие умений выделять главное, анализировать и
интерпретировать информацию, устанавливать причинно-следст-
венные связи, работать с разными источниками информации;
оформлять результаты экспериментальных исследований,
осуществлять самоконтроль и самоанализ учебной деятельности.
*Воспитательные: способствовать формированию коммуникативных умений,
воспитанию культуры общения, стремления к творческой
познавательной деятельности, продолжить формирование химической картины мира.
Оборудование: учебное пособие по физике 9 кл., химические словари, лаб.оборудование и
химические реактивы для проведения эксперимента учащихся и
демонстрации учителя.
Тип урока: комбинированный.
Методы обучения: словесно-наглядные, частично-поисковые, демонстрация, химический
эксперимент, самостоятельная работа.
Формы деятельности учащихся: фронтальная, индивидуальная, групповая.
Межпредметные связи: физика, математика, биология.
ПЛАН УРОКА:
Организационный момент
Приветствие учащихся, постановка целей и задач урока.
Актуализация знаний учащихся
1.Уравнение химической реакции получения угарного газа:
С(г)+ СО2(г) ↔ 2СО(г) - 172,5кДж
Дайте характеристику реакции по всем изученным признакам классификации.(Фронтальная беседа с учащимися)
2.Соотнесите реакции(на парты раздаются карточки с 4 реакциями и какой-то признак , учащимся предлагается проклассифицировать реакции по данному признаку в парах)
А) 4Al(тв ) + 3O2(г ) = 2Al2O3(тв) + 3350,4 КДж
Б) H2(г) + F2(г) ↔ 2HF(г) + 5237,2 КДж
B) N2(г) + O2(г )↔ 2NO(г) - 180,8 КДж
Г) Zn(тв ) +2HCl(p-p) = ZnCl2(p-p) + H2(г)↑ (Работа в парах, с дальнейшим обсуждением)
3.Творческие задачки.
А) Над нагретым чёрным порошком оксида металла четвёртого периода І В группы пропустили газообразный водород. Укажите признаки химической реакции и охарактеризуйте её по всем признакам.
Б) Небольшой кусок графита сожгли, полученный газ пропустили через избыток раствора гашёной извести. Осадок отфильтровали и обработали соляной кислотой. В атмосфере полученного газа сожгли металлический магний. Укажите число: а) гетерогенных, б) окислительно-восстановительных реакций. (Индивидуальная работа для высокомотивированных учащихся)
4.Самостоятельная тестовая работа.
1.Реакция S+O2 =SO2 является:
А) гомогенной; В) обмена;
Б) необратимой; Г) замещения.
2. В реакции разложения:
А) могут получаться только простые вещества;
Б) могут получаться только сложные вещества;
В) всегда выделяется теплота;
Г) могут получаться как простые вещества, так и сложные вещества.
3. Окислительно-восстановительной не является реакция, уравнение которой:
А)Ca + 2HCl=CaCl2 +H2 В) 2SO2 + O2 = 2SO3
Б) AgNO3=2Ag+ 2NO2 + O2 Г)CaCO3 =CaO +CO2
4.К какому типу химической реакции относится образование углекислого газа в результате:
1) взаимодействие угля с оксидом меди;
2) прокаливание известняка;
3)сжигание угля;
4) горение угарного газа?
5. Укажите схему реакции, которая соответствует характеристике – необратимая, окислительно- восстановительная, гомогенная, экзотермическая реакция:
а) Р2О5 + КОН→ KMnO4 = K2MnO4 + MnO2 +…
б) NH3 + O2 → N2 +… CaCl2 + AgNO3 →
(Взаимопроверка)
Изучение нового материала.
информация: (определение проблемного поля)
Для полного гниения брошенной в лесу газеты- 1 год.
Ржавление консервной банки – 10 лет.
Стекло практически не разрушается в течение столетий.
Формирование тромба при порезе небольших кровеносных сосудов – 3-4 сек.
А какой характеристик химических реакций идёт речь?
Актуализация знаний учащихся о скорости химической реакции из физики, математики (использование словарей, учебных пособий по физике)
Вывод Скорость какого–либо процесса – это изменение какой-либо физической величины за единицу времени. Что изменяется в ходе реакции? (Это концентрация вещества.)
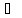 =
=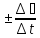 моль/дм3 *с (запись на доске, обсуждение с учащимися)
моль/дм3 *с (запись на доске, обсуждение с учащимися)
Если для расчета взята концентрация исходных веществ, то ставится знак «-», если продуктов, то «+»(объяснение учителя)
Какие факторы способны изменить скорость реации? Факторы, влияющие на скорость реакции:
Природа реагирующих веществ.
Температура.
Концентрация вещества.
Поверхность соприкосновения веществ.
Катализатор.
(Наводящие вопросы) Растворение сахара в горячем и холодном чае.
Горение 1кг бревна и 1 кг стружек
Автомобильные пробки на дорогах.(К каким явлениям можно отнести эти процессы? – физические, химические, социальные).
После обсуждения и составления схемы (приложение 1) класс делится на 5 групп. Каждая группа используя соответствующий материал §27 готовит выступление об определённом факторе с дополнением на схеме.
Выступление учащихся сопровождается демонстрацией учителя (Д.6-8)
Физкультминутка( делаем лёгкие физические упражнения стоя с разной скоростью, согласно суточной активности- утром, днём и вечером)
Закрепление изученного материала.
Выполнение лабораторного опыта №2 «Исследование влияния температуры и концентрации кислоты на скорость взаимодействия цинка(железа) и соляной кислоты. Оформление отчёта о проделанной работе.
Знание закономерностей и скоростей протекания химических реакций необходимо каждому человеку, а не только тем людям, чья профессиональная деятельность будет связана с химическим производством. Не бывает не нужных знаний, все сгодится когда-нибудь. Ответьте на вопросы, которые может вам задать сама жизнь.
1) Чтобы разжечь костёр надо взять крупные дрова или мелкие? Почему?
2) Почему скоропортящиеся продукты хранят в холодильниках?
3) Почему жидкий бензин, хранящийся в канистрах в гаражах, горит спокойно, а пары его взрывоопасны?
4) Почему на мукомольных заводах и каменноугольных шахтах иногда происходят взрывы?
5) Как замедлить процесс коррозии металлических деталей и узлов автомобиля?
Подведение итогов.
6. Домашнее задание. §26,з.3-4,§27,з.4, тв. задача (Приложение 2)
Рефлексия. А теперь я попрошу написать вас мне телеграмму. Это не должно быть больше 3 – 4 предложений телеграфного типа, в которых вы отразите своё впечатление от нашей работы сегодня
Приложение 1
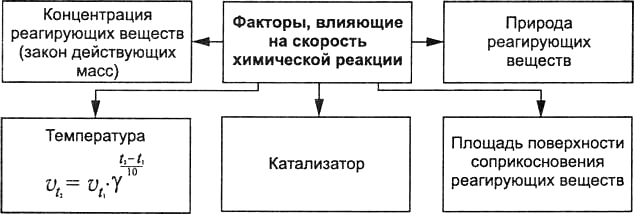
Приложение 2
В некоторой лаборатории долго пытались запустить химическую реакцию, но ничего не получалось, но потом у одного из лаборантов, когда он остался один в лаборатории - реакция пошла! Все сбежались, чтобы посмотреть, что он делает для запуска реакции, но к всеобщему разочарованию – опять ничего не получилось…. Оставшись наедине, он заново попытался провести реакцию и…она опять пошла! Стоило позвать всех, чтобы показать - реакция не идет…
В чем тут дело? Если бы лаборант применял только обычные средства для запуска реакции (нагрев, перемешивание, менял концентрацию), то это сработало бы и в присутствии сотрудников. А тут он и сам не понял, почему в одиночестве у него всё получается, а при коллегах – нет.( Предложите своё объяснение)





