Основания – сложные вещества, которые состоят из катиона металла Ме+ (или металлоподобного катиона, например, иона аммония NH4+) и гидроксид-аниона ОН—.
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания. Также есть неустойчивые основания, которые самопроизвольно разлагаются.
 Получение оснований
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например, оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий), кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например, калий реагирует с водой очень бурно:
2K0 + 2H2+O → 2K+OH + H20

3. Электролиз растворов некоторых солей щелочных металлов. Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др
Например, электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
Ca(OH)2 + K2CO3→ CaCO3↓ + 2KOH
либо
щелочь + соль1 = соль2 + основание↓
2NaOH + CuCl2→ Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + Н2SO4 = CuSO4 + 2H2O
нерастворимое основание + кислотный оксид = соль + вода
Cu(OH)2 + SO3 = CuSO4 + 2H2O
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
Cu(OH)2 + CO2 ≠
Al(OH)3 + CO2 ≠
Cu(OH)2 + SO2≠
То есть нерастворимые основания не реагируют с нерастворимыми кислотами или с неустойчивыми кислотами. Реакция возможна, только если хотя бы один реагент сильный. Либо основание сильное, либо кислота, если кислотный оксид, ему должна соответствовать сильная кислота.
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например, гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
2Fe(OH)3 = Fe2O3 + 3H2O
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
Cu(OH)2 + Al2O3≠
нерастворимое основание + амфотерный гидроксид ≠
Cu(OH)2 +Al(OH)3 ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например, гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4Fe+2(OH)2 + O20 + 2H2O → 4Fe+3(O-2H)3
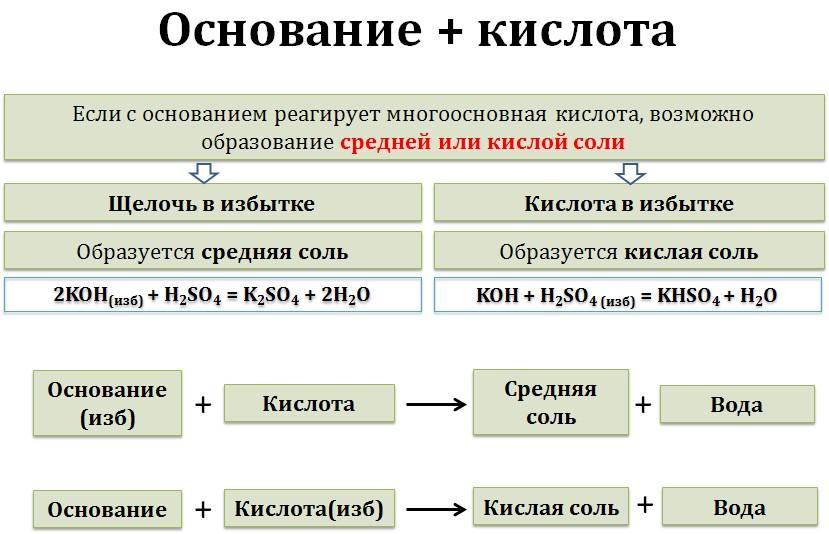
Химические свойства щелочей (растворимых оснований)Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми. При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации. Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
Например, гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: фосфаты, дигидрофосфаты, или гидрофосфаты.
щёлочь(избыток)+ кислота = средняя соль + вода
. соотношении количества щелочи и кислоты 3:1 3NaOH + H3PO4 → Na3PO4 + 3H2O
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
(соотношении количеств веществ) реагентов 1:1NaOH + H3PO4 → NaH2PO4 + H2O
соотношении количества щелочи и кислоты 2:1 2NaOH + H3PO4 → Na2HPO4 + 2H2O
2NaOH + Н2SO4 = Na2SO4 + 2H2O
NaOH + Н2SO4 = NaНSO4 + H2O
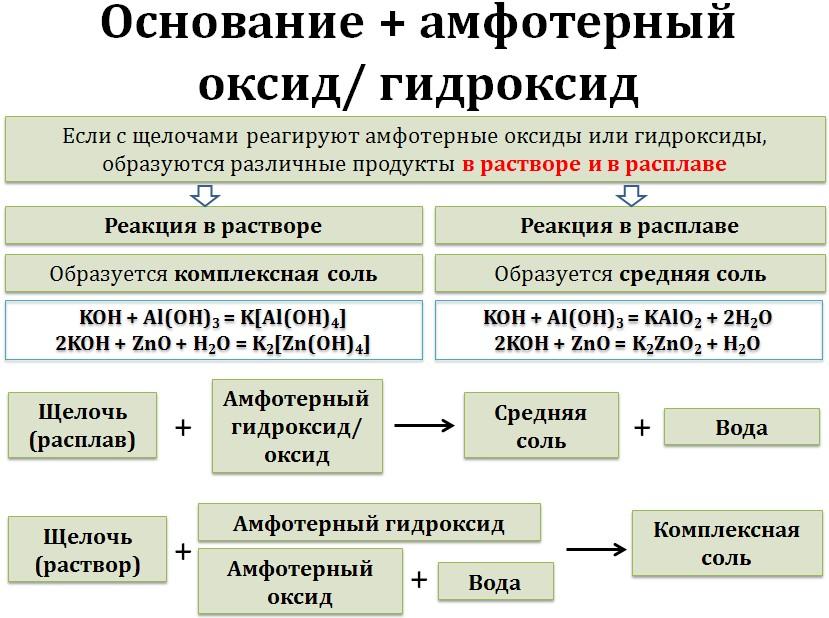
2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли, а в растворе – комплексные соли.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
2NaOH + Al2O3 = 2NaAlO2 + H2O
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
NaOH + Al(OH)3 = NaAlO2 + 2H2O
щёлочь (раствор) + амфотерный оксид = комплексная соль
2NaOH + Al2O3 + 3H2O = 2Na[Al(OH)4]
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
NaOH + Al(OH)3 = Na[Al(OH)4]
Например, при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия.
А в растворе образуется комплексная соль:
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
а) избытка гидроксида натрия
щёлочь(избыток) + кислотный оксид = средняя соль + вода
2NaOH(избыток) + CO2 = Na2CO3 + H2O
б) избытка углекислого газа
щёлочь + кислотный оксид(избыток) = кислая соль
NaOH + CO2(избыток) = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе, при условии, что в продуктах образуется газ или осадок. Такие реакции протекают по механизму ионного обмена.
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
щёлочь + растворимая соль = соль + соответствующий гидроксид
- 2Na+OH—+ Cu2+SO42= Na2+SO42- +Cu2+(OH)2—↓
Также щёлочи взаимодействуют с растворами солей аммония.
Например, гидроксид калия взаимодействует с раствором нитрата аммония:
K+OH— + NH4+NO3— = K+NO3— + NH3↑ + H2O
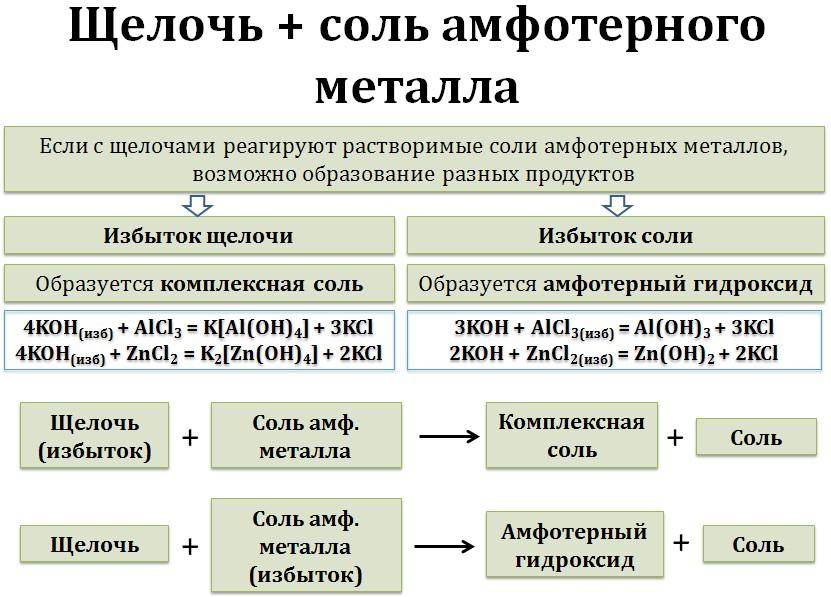
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид, взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла.
Например, избыток сульфата цинка реагирует в растворе с гидроксидом калия:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
ZnSO4(избыток) + 2KOH = Zn(OH)2↓ + K2SO4
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей. Таким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
ZnSO4 + 4KOH(избыток) = K2[Zn(OH)4] + K2SO4
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
KHSO3 + KOH = K2SO3 + H2O
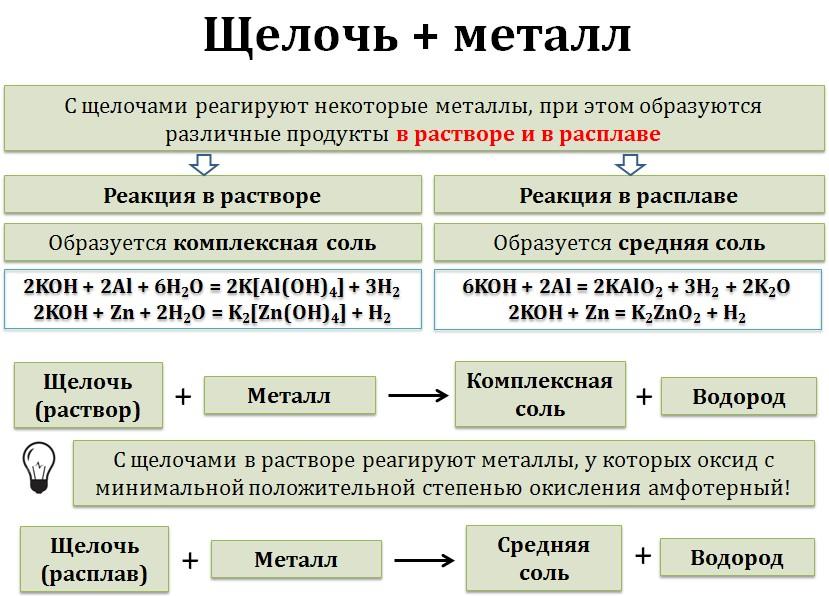
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, Если металл амфотерный, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых в амфотерном оксиде металл с минимальной положительной степенью окисления!
Например, железо и хром не реагируют с раствором щёлочи, так как железо и хром проявляют минимальную степень окисления +2 в оксид железа (II) и оксид хрома (II) — это основные оксиды. То есть в амфотерных оксидах степень окисления железа и хрома не минимальная, она равна +3.
Fe + NaOH≠
А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный и алюминий в нём в минимальной степени окисления +3:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Сера S, селен Se и теллур Te растворяются в концентрированном растворе щелочи:
При н.у. образуется тиосульфат - K2S2O3
4S + 6KOH =2K2S + K2S2O3 + 3H2O,
При нагревании и когда щёлочь концентрирован образуется сульфит
3S + 6KOH =2K2S + K2SO3 + 3H2O,
3Se + 6NaOH = Na₂SeO₃ + 2Na₂Se + 3H₂O
3Te + 6NaOH = Na₂TeO₃ + 2Na₂Te + 3H₂O
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl20 = NaCl— + Na Cl+ O+ H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
4F2 + 6NaOH (разб. ) = 6NaF + OF2+ О2+ 3H2O,
Бром Br₂ и йод I₂ реагируют единственным образом переходят в степени окисления -1 и +5:
3Br₂ + 6NaOH = 5NaBr + NaBrO₃ + 3H₂O
3I₂ + 6NaOH = 5NaI + NaIO₃ + 3H₂O
Фосфор при нагревании -3 и +1
4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3.
Белый фосфор P₄ также растворим в концентрированной щелочи:
Р4+ 3NaOH + 3H2O = 3NaH₂PO₂ + PH₃

8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O





