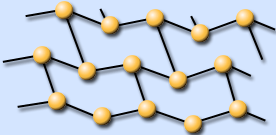
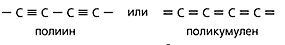Аллотропия- способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся лишь числом атомов в молекуле, либо строением. Углерод
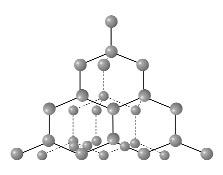
| Алмаз- SP3 гибридизация
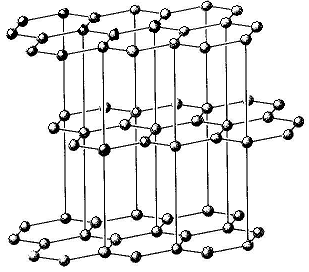
| Графит- SP2 гибридизация
|
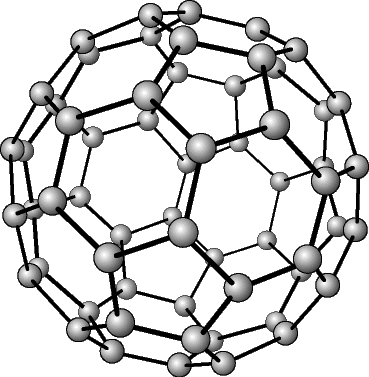
| Фулерен -SP2 гибридизация
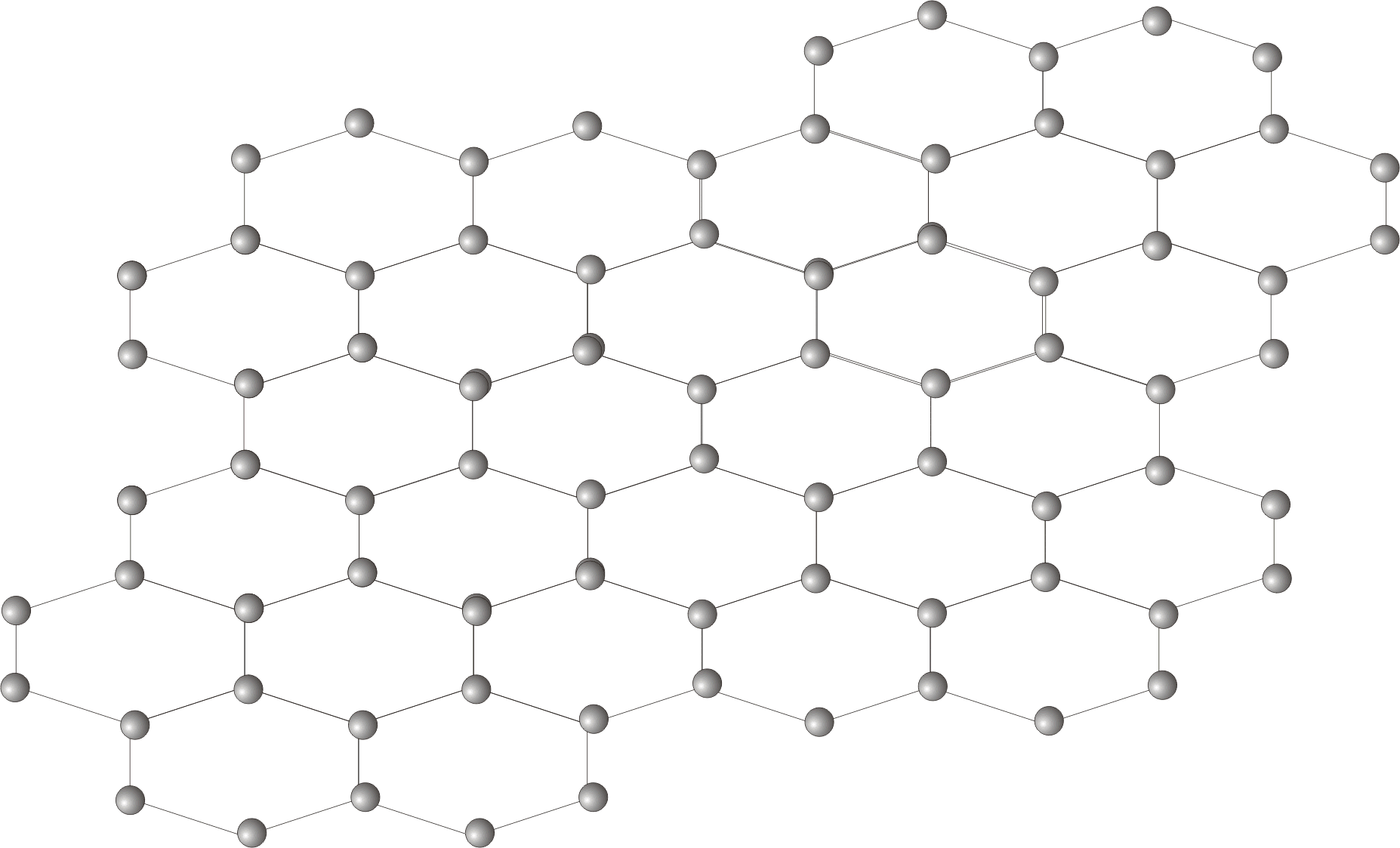
| Графен-SP2 гибридизация
|
| Карбин -SP гибридизация
|
|
| Признаки | Алмаз (С) | Графит (С) |
| Состав молекулы | атомы углерода | атомы углерода |
| Цвет | Прозрачный | Серо-чёрное вещество, с металлическим блеском, жирное на ощупь |
| Агрегатное состояние | Очень твёрдый | Мягкий |
| Теплопроводность и электропроводность | Не проводит тепло и электричество | Проводит тепло и электричество |
| Тип кристаллической решётки | Атомная | Атомная |
Аллотропия углерода обусловлена различным расположением атомов в кристаллической решётке
Алмаз и графит-атомная кристаллическая решётка, Фулерен-молекулярная (С60)
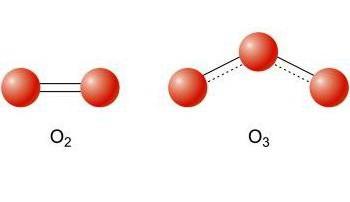
Кислород существует в виде двух аллотропных модификаций –O2 и О3
Вещество, формула которого O2, встречается в атмосфере, гидросфере, земной коре и живых организмах. Около 20% атмосферы образовано двухатомными молекулами кислорода. В стратосфере на высоте примерно 12–50 км от земной поверхности находится слой, получивший название «озоновый экран». Его состав отражает формула O3. Озон защищает нашу планету, интенсивно поглощая опасные лучи красного и ультрафиолетового спектра Солнца.
Сравнение кислорода и озона
| Признаки | Кислород | Озон |
| Состав молекулы | 2 атома кислорода | 3 атома кислорода |
| Строение |
| |
| Агрегатное состояние и цвет | Бесцветный прозрачный газ либо бледно-голубая жидкость | Голубой газ, жидкость синего цвета, темно-фиолетовое твердое вещество |
| Запах | Отсутствует | Острый, напоминающий о грозе, свежескошенном сене |
| Температура плавления (°С) | -219 | -193 |
| Точка кипения (°С) | -183 | -112 |
| Плотность (г/л) | 1,4 | 2,1 |
| Растворимость в воде | Мало растворяется | Лучше, чем у кислорода |
| Химическая активность | При обычных условиях стабилен | Легко разлагается с образованием кислорода |
| Тип кристаллической решётки | Молекулярная | Молекулярная |
. Аллотропия кислорода и озона обусловлена различным числом кислорода в молекулах веществ.
Аллотропия кислорода
| Кислород О2 | Озон О3 |
| Физические свойства | |
| Кислород - один из самых часто встречающихся элементов в природе, в атмосфере на его долю приходится 21%. Он поддерживает жизнь на планете и делает возможным горение. Самый распространенный элемент на Земле, является компонентом большинства горных пород и минералов. Более 60% массы человеческого тела приходится на кислород. Бесцветный, не обладающий запахом газ - кислород, плохо растворим в воде и немного тяжелее воздуха. При охлаждении до -183С кислород становится прозрачной голубоватой жидкостью с плотностью, превышающей плотность воды. | Озон О3 находится в стратосфере на высоте 25-50 километров, образуя озоновый слой. Озон образуется при разложении кислорода под воздействием ультрафиолетовых солнечных лучей, а также при атмосферных разрядах. Свое название он получил благодаря сильному запаху (от греческого слова ozon– душистый). Это бледно-голубой нестабильный газ. Легко растворяется в воде, обладает бактерицидными свойствами и используется для дезинфекции воды и воздуха. В больших количествах озон опасен. Благодаря своей способности поглощать ультрафиолетовые лучи, озон защищает живые организмы – людей, животных и растения – от опасного УФ-излучения Солнца. |
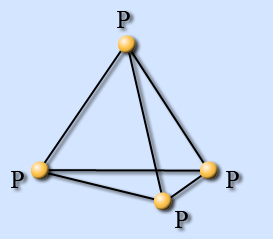
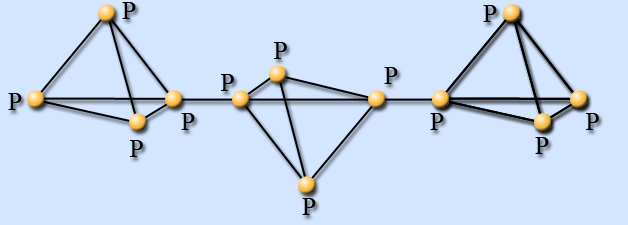
Аллатропия фосфора
| Признаки | Красный фосфор(Р) | Белый фосфор(Р4) |
| Состав вещества | атомы фосфора | Молекулы фосфора |
| Цвет | Кирпично-красный | Желтовато-воскообразное вещество |
| Запах | Без запаха | Запах чеснока |
| Растворимость | Растворяется в воде и сероуглероде | Не растворяется в воде, хорошо растворяется в сероуглероде |
| Влияние на организм | Не ядовит | Ядовитое вещество |
| Свечение в темноте | Не светится | Светится |
| Химическая активность | Менее химически активен, горит при поджигании | Более химически активен, самовоспламеняется на воздухе |
| Тип кристаллической решётки | атомная | Молекулярная |
Аллотропия фосфора обусловлена различной кристаллической решёткой
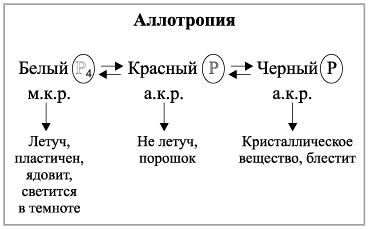
| Белый
| Красный
|
| Чёрный
|
|
Аллатропия серы
| Признаки | Сера ромбическая(S8) | Сера пластическая(S) |
| Состав вещества | Молекулы Серы | Атомы серы |
| Цвет | Жёлтый | Тёмно-коричневый |
| Запах | Без запаха | Без запаха |
| Агрегатное состояние | Хрупкое | Тянется как резина |
| Температура плавления | Легкоплавкая, +112,80С. | Плавится хуже, +444,60С |
| Тип кристаллической решётки | Молекулярная | Атомная |
Аллотропия серы обусловлена различной кристаллической решёткой
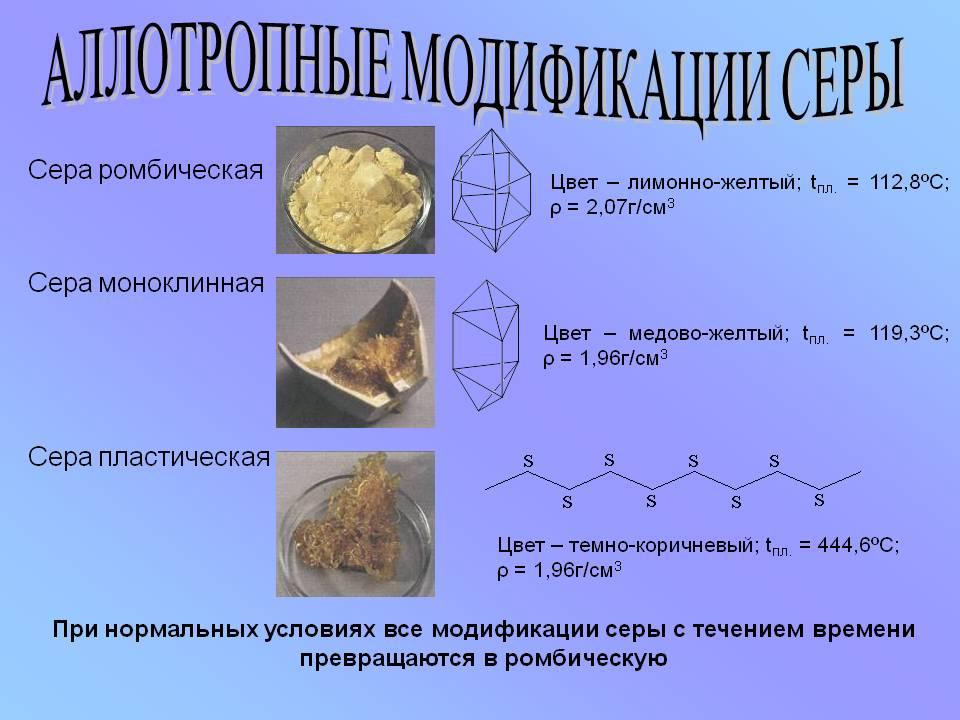
ромбическая, моноклинная и пластическая.
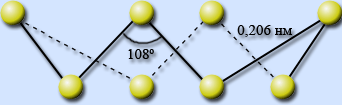
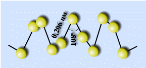
| Молекула S8 имеет форму короны, длины всех связей – S – S – равны 0,206 нм и углы близки к тетраэдрическим 108°. | Пластическая модификация серы образована спиральными цепями из атомов серы с левой и правой осями вращения. Эти цепочки скручены и вытянуты в одном направлении.
|
|
|
|