Дата ______ Урок № Класс 11
Учитель:
Предмет химия
Тема: «Металлы побочных подгрупп»
Цель: Повторить и обобщить знания о металлах на примере металлов представителей побочных подгрупп (меди, железа, хрома); углубить знания об их свойствах и применении.
Задачи:
Образовательная: Изучить строение, свойства и применение металлов побочных подгрупп
Развивающие: 1. Создать условия для развития логического мышления через сравнение и установление взаимосвязи строения и свойств веществ с учетом зоны ближайшего развития 2. Формирование умений переносить полученные знания в новую ситуацию
Воспитательные: 1. Формирование научного мировоззрения через познаваемость химических явлений 2. Формирование умений осуществлять самоконтроль хода и результатов своего труда 3. Развитие коммуникативности личности
Планируемые результаты:
Знать строение атома, физические и химические свойства, получение и применение металлов побочных подгрупп.
Уметь составлять электронные формулы атомов металлов побочных подгрупп на примере меди, железа, хрома; записывать уравнения реакций, характеризующих химические свойства, способы получения.
Тип урока: изучение нового материала
Оборудование: компьютер, мультимедийный проектор, карточки с тестами, коллекция «Металлы», периодическая система химических элементов.
Ход урока
I.Организационный момент.
II.Актуализация опорных знаний
Устный опрос по пройденному материалу:
Прежде, чем мы приступим к изучению нового материала вспомним материал прошлого занятия. Постарайтесь ответить на вопросы.
- В какой части Периодической системы в основном расположены металлы?
Ответ: в левой нижней части таблицы
- Что общего в физических свойствах всех металлов?
Ответ: высокая электрическая проводимость, теплопроводность, ковкость, пластичность
- По каким характерным физическим свойствам металлы в значительной степени отличаются друг от друга?
Ответ: по плотности, твердости, температуре плавления
- Назовите самый легкий и самый тяжелый металл
Ответ: самый легкий литий, тяжелый осмий
- У какого из металлов самая низкая и самая высокая температура плавления?
Ответ: ртуть –38,9 ; вольфрам 3390
- Какие металлы мы изучали на последнем занятии?
Ответ: металлы главных подгрупп
- Назовите несколько металлов главных подгрупп
Ответ: литий, натрий, калий, магний, кальций и др.
- Назовите общее химическое свойство металлов главных подгрупп
Ответ: это их способность легко отдавать валентные электроны вследствие гораздо большего атомного радиуса по сравнению с неметаллическими элементами, поэтому являются восстановителями
III.Самоопределение к деятельности
- На сегодняшнем занятии мы познакомимся с еще одной группой металлов, среди которых наибольшее практическое значение имеют: медь, цинк, титан и железо
- Возникает вопрос, почему эти металлы изучаются отдельно?
Чтобы ответить на этот вопрос – выясните в чем отличие в расположении этих элементов в таблице Менделеева от ранее изученных металлов?
Ответ: эти металлы находятся в побочных подгруппах
- После этого обсуждения, ваших ответов на вопросы постарайтесь сформулировать тему сегодняшнего занятия
Ответ: «Металлы побочных подгрупп»
- Какие цели вы ставите перед собой на уроке?
Ответ: узнать, изучить строение, свойства и применение металлов побочных подгрупп
- Давайте вместе обсудим план работы на сегодняшнем занятии. Предложите свои пункты плана по которому можно будет достичь вашей цели на уроке.
Ответ: предлагают изучить строение, физические, химические свойства и т.д
План урока
1) Исторические данные
2) Строение атома
3) Физические свойства
4) Химические свойства
5) Получение
6) Применение
В течении урока, вам необходимо будет сделать краткий конспект - записать необходимые данные, которые вы узнаете на занятии.
- Ответьте на вопрос: «Для чего, где вам пригодятся знания полученные на сегодняшнем уроке?»
IV. Изучение нового материала
а) Исторические данные (первые сведения и т.п.) – сообщения учащихся
б) Строение атома
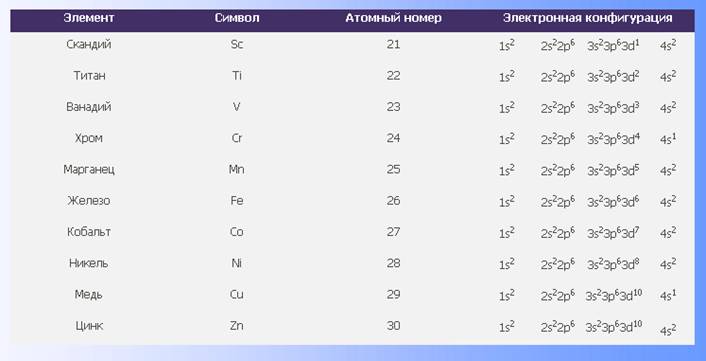
– Электронное строение атомов меди, железа, хрома
Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).
в) Физические свойства меди, железа, хрома
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Медь — довольно мягкий металл красно-желтого цвета, ковкий, пластичный, обладает высокой тепло - и электропроводностью. Tплавл= 10830С. ρ = 8,96г/см3. СО: 0,+1,+2
Железо – сравнительно мягкий ковкий металл серебристого цвета, пластичный, намагничивается. Tплавл=15390С. ρ = 7,87г/см3.
СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов
+3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.
Хром — твердый, голубовато-белый металл. ρ = 7,2г/см3, tплавл= 18570С
СО: +1,+2,+3,+4,+5,+6
г) Химические свойства меди, железа, хрома
Химические свойства меди
I. Взаимодействие с простыми веществами.
1. При высокой температуре взаимодействует с кислородом: 2Cu + O2 ![]() 2CuO
2CuO
2. Взаимодействует с неметаллами при высоких температурах: Cu + Cl2 ![]() CuCl2
CuCl2
II. Взаимодействие со сложными веществами.
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3(конц.) → Cu(NO3)2 + 2NO2↑+ 2H2O
Cu + 2H2SO4(конц.) → CuSO4 + SO2↑+2H2O
Химические свойства железа
I. Взаимодействие с простыми веществами.
1. Горит в кислороде, образуя окалину - оксид железа (II, III): 3Fe + 2O2 → Fe3O4
2. Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 ![]() 2FeBr3
2FeBr3
Fe + S ![]() FeS
FeS
II. Взаимодействие со сложными веществами.
1. При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O ![]() Fe3O4 + 4H2 ↑
Fe3O4 + 4H2 ↑
2. На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О → 4Fе(ОН)3.
3. Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4(разб.) → FeSO4 + H2↑
4. В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
2Fe + 6H2SO4(конц.) ![]() Fe2(SO4)3 + 3SO2 + 6H2O
Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) ![]() Fe(NO3)3 + 3NO2 + 3H2O
Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5. Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu↓
Химические свойства хрома
I. Взаимодействие с простыми веществами.
1. При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 ![]() 2Cr2O3
2Cr2O3
2Cr + 3Cl2 ![]() 2CrCl3
2CrCl3
2Cr + N2 ![]() 2CrN
2CrN
2Cr + 3S ![]() Cr2S3
Cr2S3
II. Взаимодействие со сложными веществами.
1. В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O ![]() Cr2O3 + 3H2
Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:
2 Сr + 6 Н2SО4(конц) ![]() Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц) ![]() Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Сr(NО3)3 + 3 NO2↑ + 3 Н2О
д) Получение
Получение меди
1. Восстановлением из оксидов углём или оксидом углерода (II): CuO + C ![]() Cu + CO
Cu + CO
CuO + CO ![]() Cu + CO2
Cu + CO2
2. При электролизе солей меди: 2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Получение железа
1. Восстановлением из оксидов углём или оксидом углерода (II)
FeO + C ![]() Fe + CO
Fe + CO
Fe2O3 + 3CO ![]() 2Fe + 3CO2
2Fe + 3CO2
Получение хрома
1. Алюминотермия: Cr2O3 + 2Al ![]() Al2O3 + 2Cr
Al2O3 + 2Cr
2. Восстановлением оксидов хрома оксидом углерода (II), водородом:
CrO + Н2 ![]() Cr + H2O
Cr + H2O
е) Применение меди, железа, хрома
V.Закрепление
– Напишите электронное строение атома меди
– Допишите уравнения реакций:
а) Fe + O2 б) Cr + H2SO4 в) Cu + Cl2
Тест по теме урока
1) Электронная формула 1s 2 2s2 2p6 3s2 3p6 3d2 4s2 принадлежит:
а) Zn б) Ti в) Cu г) Fe
2) Определите металл по следующим данным: светло-розовый цвет, тягучий, вязкий, легко прокатывается. Температура плавления 1083С. По проводимости электрического тока уступает лишь серебру.
а) Zn б) Ti в) Cu г) Fe
3) Степень окисления железа в формуле Fe2O3:
а) –2 б) + 4 в) + 2 г) + 3
4) Металлические свойства в ряду Ti Cr Fe:
а) уменьшаются б) увеличиваются в) не изменяются г) изменяются периодически
x y
5) В схеме превращений Cr → CrCl3 → Cr(OH)3
веществами x и y могут быть соответственно
а) Cl2 , H2O б) Cl2 , NaOH в) NaCl , KOH г) HCl , KOH
VI .Итог урока.
VII.Рефлексия.
Допишите предложения:
Какая цель была на уроке _________________
Достиг ли ты поставленной цели ____________
Что тебе помогло достичь цели? _______________
Я узнал на уроке _____________
Я не согласен _____________
На уроке столкнулся со следующими трудностями ___________
Поставьте себе оценку за урок _______
VIII. Домашнее задание: изучить § 28
Выполните одно из трех заданий по своим возможностям
«3» - Допишите уравнения: а) Fe+ Cl2 б) Ti(IV) + O2 в) Zn + HNO3
«4» – Напишите уравнения реакций по схеме: Zn ZnO ZnSO4 Zn(NO3)2
«5» – Напишите уравнения реакций по схеме, заменив «X» и «Y» соответствующей формулой: Fe(III) «X» «Y» Fe2O3





