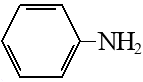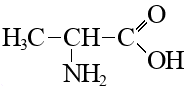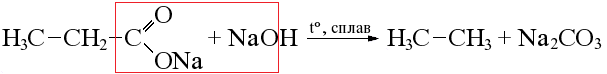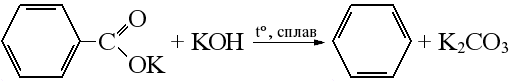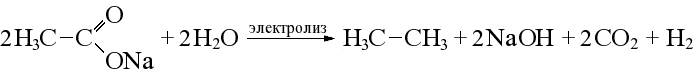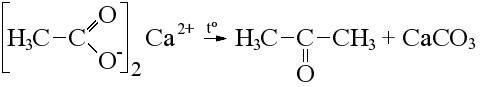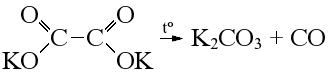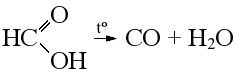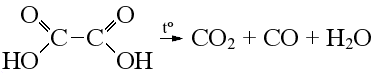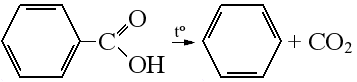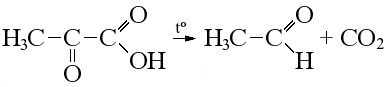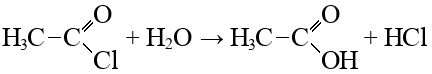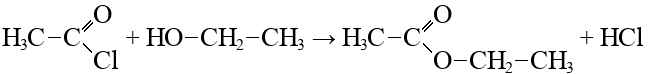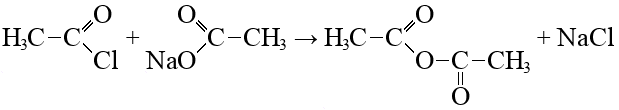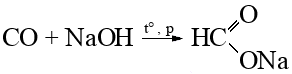|
Терефталевая кислота |
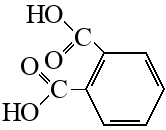
Фталевая кислота |
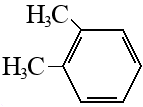
О-ксилол |
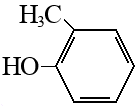
О-крезол |
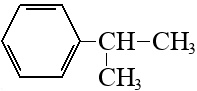
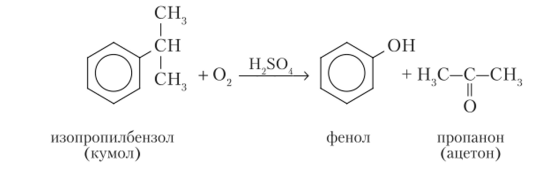
Кумол | ||
|
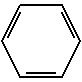
Бензол |
Фенол |
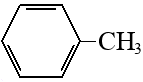
Толуол |
Анилин |
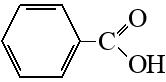
Бензойная кислота | ||
|
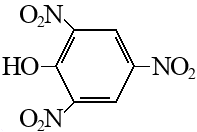
Пикриновая кислота |
Глицин |
Аланин |
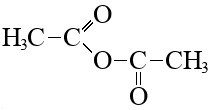
Уксусный ангидрид |
CnH2nO
| ||
| Гидрогенизация + Н2 | ||||||
| Элеминирование (отщепление) | ||||||
| Декарбоксилирование Реакция Дюма – это сплавление солей карбоновых кислотw с щелочами. При этом отщепляется карбоксилатная группа (–COOMe), и образуется карбонат: пропионат натрия → этан бензоат калия → бензол | ||||||
| Электролиз по Кольбе 2CH3CH2–COONa + 2H2O → H2 + 2NaOH + 2CO2 + CH3CH2–CH2CH3 | ||||||
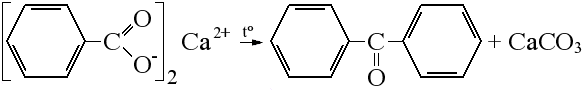
| Разложение термически неустойчивых солей* Соли двухвалентных металлов (Ca, Mg, Ba) термически неустойчивы, при нагревании они разлагаются с отщеплением карбоната, остатки молекулы соединяются с образованием кетона: бензоат кальция → бензофенон Термически неустойчивы также оксалаты любых металлов. Оксалаты разлагаются на карбонат и угарный газ: | ||||||
| Разложение термически неустойчивых кислот* Важнейшие термически неустойчивые кислоты: Муравьиная кислота разлагается до угарного газа: Щавелевая кислота разлагается до углекислого и угарного газа: Бензойная кислота при нагревании декарбоксилируется, образуется бензол: Карбоновые кислоты, у которых карбоксильная группа находится рядом с электроноакцепторным заместителем, являются термически неустойчивыми, при нагревании такие кислоты теряют карбоксильную группу в виде CO2, например, пировиноградная кислота разлагается до ацетальдегида: | ||||||
| Окисление кумола | ||||||
| Хлористый ацетил ацетилхлорид + вода → уксусная кислота + соляная кислота ацетилхлорид + этанол → этиловый эфир уксусной кислоты + соляная кислота ацетилхлорид + ацетат натрия → уксусный ангидрид + хлорид натрия | ||||||
| Синтез газ: C + H2O → H2 + CO.; CH4 + H2O → CO + 3H2 CO+2H2⇔СH3OH+90,8кДж | ||||||
| угарный газ + гидроксид натрия → (t°, p) → формиат натрия | ||||||
| Реакция первичных аминов с азотистой кислотой* этиламин + азотистая кислота → этанол + азот↑ + вода | ||||||
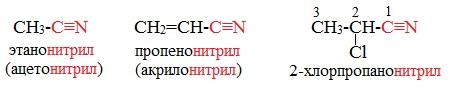
| Гидролиз нитрилов CH3CN + 2H2O + HCl → CH3COOH + NH4Cl | ||||||
| Электролиты: Сильные а) кислоты НNO3 , HCl, HBr , HI НСlО4 (хлорная), НСlО3 (хлорноватая), H2SO4, HMnO4 | ||||||
| б) основания –растворимые: Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН)2 | ||||||
| в) Все растворимые соли. | ||||||
| К слабым электролитам относятся а) некоторые неорганические и почти все органические кислоты: HF, H2S , H2SO3, H2CO3, HCN, Н3РО4,, H2SiO3, H3BO3, НСlО (Хлорноватистая кислота), СН3СООН , | ||||||
| б) основания – нерастворимые Аl(OH)3, Cu(OH)2, Fe(OH)2, Fe(OH)3 и др. и гидроксид аммония NH4OH. | ||||||
| 2KF тв + H2SO4 конц → K2SO4 (KHSO4)+ 2HF↑ 2NaCl тв + H2SO4 конц → Na2SO4 + 2HCl↑ 8NaBr + 5H2SO4 → H2S + 8Br + 4Na2SO4 + 4H2O 8NaI +5H2SO4 = 4I2 + H2S + 4Na2SO4 + 4H2O. | ||||||
| | ||||||