
Железо – знакомый всем металл
МБОУ Балабановская ООШ №13
Клименко Галина Алексеевна.,
учитель химии и биологии

- Железо не только основа всего мира,
самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлым, настоящим и будущими судьбами человечества.
А. Е. Ферсман .

Физминутка:
«Клоуны»
- Брови свести и развести;
- Глаза сильно прищурить и широко открыть;
- Губы максимально растянуть в улыбке, а затем поджать их;
- Шею максимально вытянуть, а затем опустить её;
- Плечи максимально свести и развести;
- Руками обнять себя, погладить и пожелать себе успехов, улыбнуться.

Охарактеризуйте Fe как химический элемент, составив предложения со словами и словосочетаниями:
- Порядковый номер, номер периода , группа, подгруппа
- Порядковый № 26, 4 период , VIII В группа
- Заряд ядра, распределение электронов по уровням
- Заряд ядра +26, распределение é 2, 8, 14, 2
- Электронная формула внешнего уровня
- … 4 s 2 3d 6
- Степени окисления
- +2, + 3
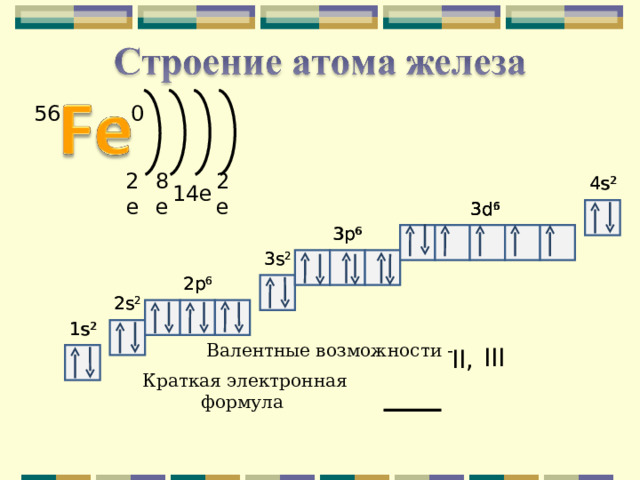
0
56
4 s 2
4 s 2
2e
8e
1 4 e
2e
3d 6
3d 6
3d 5
3p 6
3p 6
3s 2
3s 2
2p 6
2p 6
2s 2
2s 2
1 s 2
1 s 2
III
II,
Валентные возможности -
Краткая электронная формула

Физические свойства железа
- металлический блеск
- теплопроводность
- электропроводность
- пластичность и ковкость
- магнетизм
5

физические свойства железа:
- Серебристо-белый металл
- Металлический блеск
- T емпература плавления +1539 о С
- Пластичный, ковкий
- Проводит электрический ток
- Проводит тепло
- Легко намагничивается и размагничивается
5

Химические свойства железа
Взаимодействие железа с хлором:
2 Fe + 3 Cl 2 = 2 FeCl 3
5

Химические свойства железа
Взаимодействие железа с кислородом:
Fe + O 2 =
Fe 3 O 4
(FeO*Fe 2 O 3 )
3
2
5

Химические свойства железа
2 Fe + 3 Cl 2 → 2 FeCl 3
6 Fe + 4 O 2 → 2 Fe 3 O 4
Fe + 2HCl ( разб) → FeCl 2 + H 2
Fe + CuSO 4 → Cu + FeSO 4
3 Fe + 4 H 2 O (пар) → Fe 3 O 4 + 4 H 2
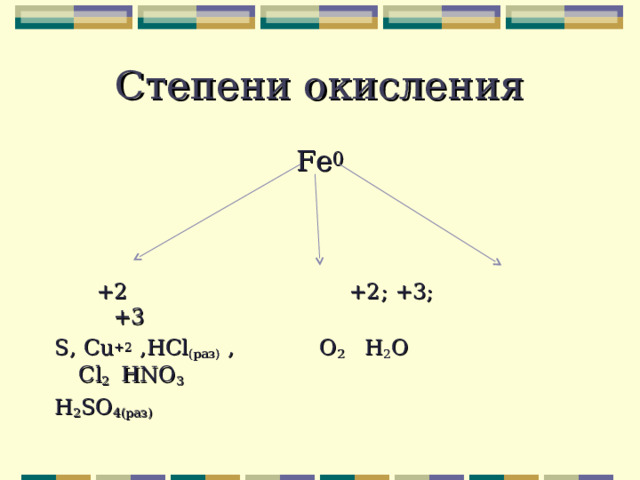
Степени окисления
Fe 0
+2 +2 ; +3; +3
S , Cu +2 , HCl ( раз) , O 2 H 2 O Cl 2 HNO 3
H 2 SO 4 (раз)

ПРИМЕНЕНИЕ
- Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления трансформаторов, электромоторов и мембран микрофонов. Основная масса железа на практике используется в виде сплавов – чугуна и стали.
- Железо - самый употребляемый металл, на него приходится до 90 % мирового производства металлов.

Нахождение в природе
- В земной коре 5,1% железа, 4 место после кислорода, кремния и алюминия.
- По запасам железных руд Россия занимает 1 место в мире.

Нахождение в природе
Метеоритное железо
- Запишите не менее 4 -х формул соединений железа, встречающихся в природе

Природные соединения железа
FeS
Пирит
FeCO 3
Сидерит
Fe
(железный или серный колчедан)
Fe 3 O 4
(магнитный железняк)
Fe 2 O 3 *3H 2 O Лимонит
Fe 2 O 3
(красный железняк)
(бурый железняк)

«Попс-формула»
- Сегодня я понял(а), что ………..
- Главным на уроке для меня было ……….
- Больше всего мне запомнилось ……….

Домашнее задание
- § 41, с. 188 -191 № 1 с. 190 - всем
- № 5 с. 191 (задача), по желанию

Спасибо за работу!





