
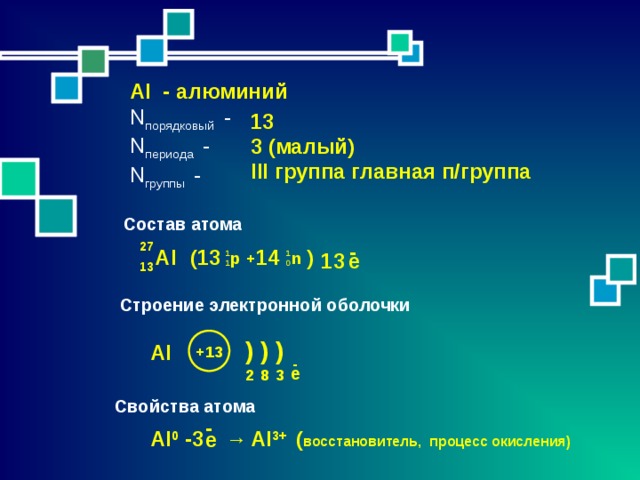
Al - алюминий
N порядковый -
N периода -
N группы -
13
3 (малый)
III группа главная п/группа
Состав атома
-
27
(13
14
)
Al
е
13
р
n
11
+
10
13
Строение электронной оболочки
)
)
)
+13
Al
-
е
3
2
8
Свойства атома
-
Al 0
-3
→
Al 3+
( восстановитель, процесс окисления)
е

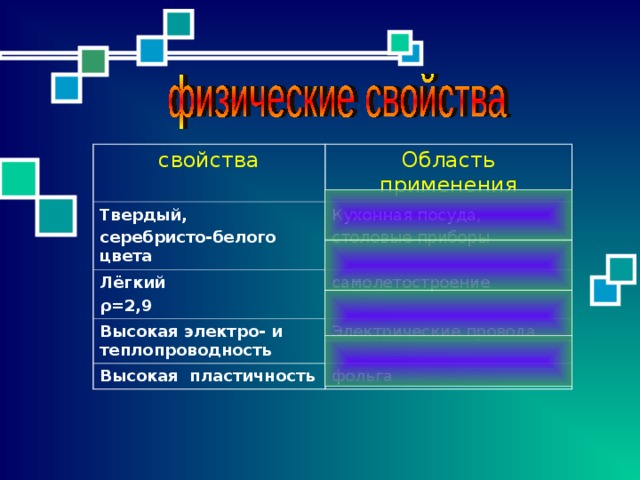
свойства
Область применения
Твердый,
серебристо-белого цвета
Кухонная посуда,
столовые приборы
Лёгкий
ρ =2,9
самолетостроение
Высокая электро- и теплопроводность
Электрические провода
Высокая пластичность
фольга
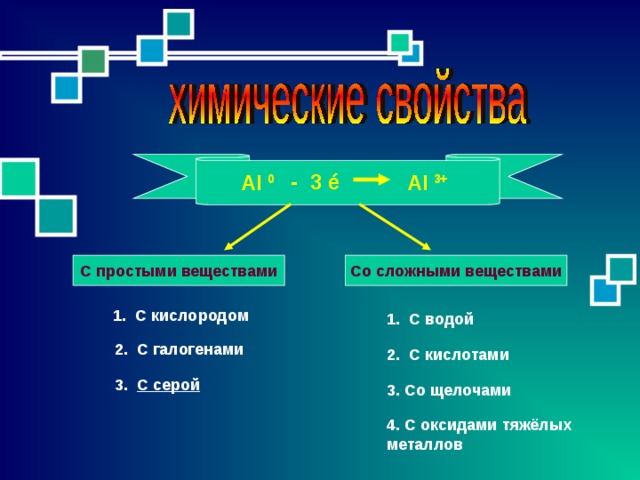
3+
- 3 é
0
Al
Al
Со сложными веществами
С простыми веществами
1. С кислородом
1. С водой
2. С галогенами
2. С кислотами
3. С серой
3. Со щелочами
4. С оксидами тяжёлых
металлов

С кислородом
4 АL + 3O 2 2 AL 2 O 3
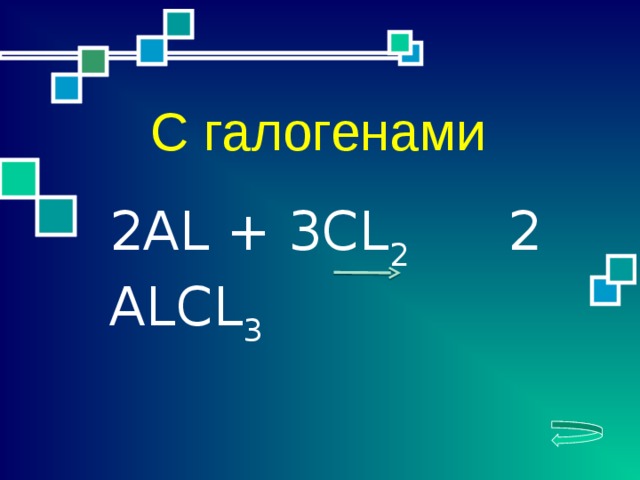
2АL + 3CL 2 2 ALCL 3
С галогенами
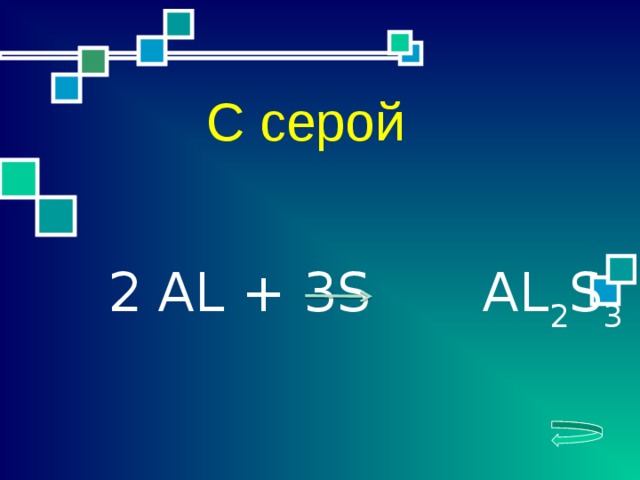
2 АL + 3S AL 2 S 3
С серой
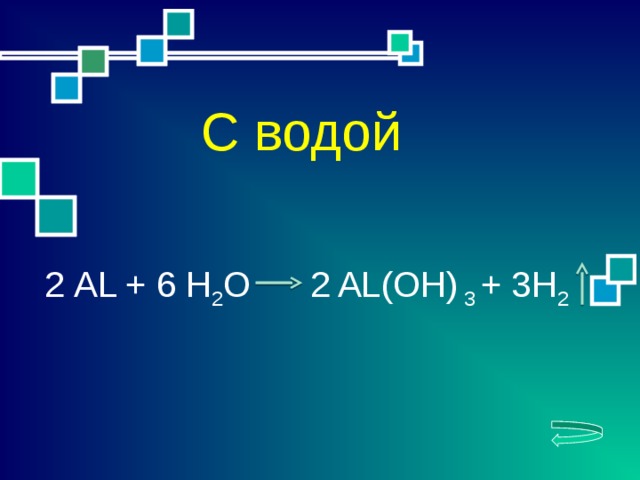
С водой
2 АL + 6 H 2 O 2 AL(OH) 3 + 3H 2
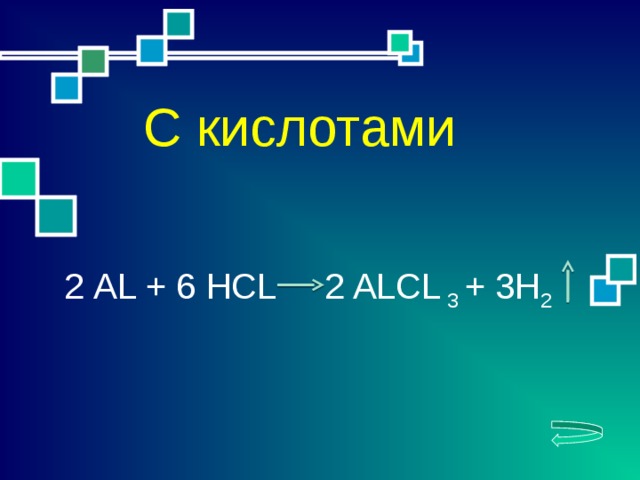
С кислотами
2 АL + 6 HCL 2 ALCL 3 + 3H 2
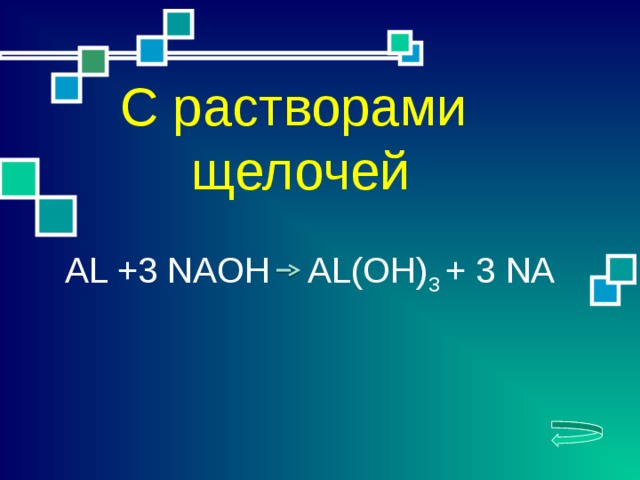
С растворами
щелочей
AL +3 NAOH AL(OH) 3 + 3 NA
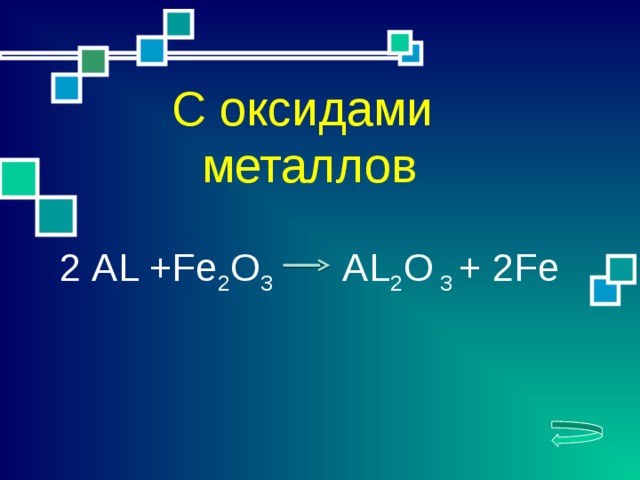
С оксидами
металлов
2 АL +Fe 2 O 3 AL 2 O 3 + 2Fe

1. Алюминий - это активный металл
2. Взаимодействует с простыми веществами (кислородом , галогенами, серой)
3. Взаимодействует со сложными веществами (с водой, с кислотами, со щелочами, с оксидами металлов)
4. Алюминий проявляет амфотерные свойства, т.е. может взаимодействовать и с кислотами, и со щелочами.





