План-конспект урока по химии в 7 классе
Тема урока: Понятие о кислотах. Понятие об индикаторах.
Цель урока: Сформировать представление о составе и свойствах кислот, валентности кислотных остатков. Ввести понятие об индикаторах. Развивать умения обращаться с неорганическими веществами и лабораторным оборудованием
Задачи урока: 1) продолжить формирование понятий о химических веществах: ввести понятие «кислоты», «индикаторы»;
2) создать условия для экспериментального ознакомления с индикаторами, изменением их окраски под действием кислот;
3) развивать умения работать с химическими реактивами, наблюдать, анализировать;
Оборудование и реактивы: штатив с пробирками, фильтровальная бумага, универсальная индикаторная бумага, растворы серной кислоты, индикаторов (лакмуса, метилоранжа), соляной кислоты, концентрированной серной кислоты.
Тип урока: комбинированный
Формы организации учебно-познавательной деятельности учащихся: фронтальная, индивидуальная.
Методы: словесные, наглядные.
Учебно-методическое обеспечение: учебное пособие, рабочая тетрадь, раздаточный материал.
Ход занятия
1. Организационно-мотивационный момент.
- Здравствуйте, дети! Садитесь.
Французский писатель Антуан Франс однажды заметил: «учиться можно только с аппетитом ... Чтобы переварить знания, необходимо поглощать их с аппетитом». По этому, давайте же сегодня на уроке будем поглощать знания с большим желанием. Тогда и урок у нас получитцочень интересным и эффективным. Давайте друг другу улыбнемся и мысленно пожелаем себе удачи.
2. Проверка выполнения домашнего задания
Прежде, чем мы с вами приступим к изучению новой темы, давайте пересмотрим наш багаж - знания и проверим домашнее задание. Были ли у вас трудности с выполнением домашнего задания?
Вам были на дом номера 3,4,5 после параграфа 21.обменяйтесь тетрадями и обращайтесь с ответами на экране.
№ 3
а)Cu2O+H2= 2Cu+H2O;
б)Fe2O3+3H2= 2Fe+3H2O;
в)HgO+ H2= Hg+H2O.
№4
а) H2+ZnO =Zn+H2O(реакция замещения); б)2H2+O2=2H2O(реакция замещения);
в) H2+ Fe2O3=2Fe+3H2O(реакция замещения); г) 3H2+WO3=W+3H2O (реакция замещения).
№ 5
а) 1)2Сu + O2=2CuO; 2) CuO +H2= Cu +H2O.
б)1) Fe2O3+ 3Н2 = 2Fe+3H2O; 2)2 Fe +O2=2FeO.
- Есть ли у вас ошибки в выполнении домашнего задания?
- Молодцы! Вы хорошо справились с этим заданием.
3. Актуализация изученного ранее
- На прошлом уроке мы изучали с вами тему «химические свойства водорода». Ответьте мне, пожалуйста, на следующие вопросы.
1. Скажите, с какими веществами реагирует водород? (Водород реагирует с простыми веществами ( кислород, хлор) и со сложными веществами (с оксидами).
2. к какому типу реакций относится реакция взаимодействия водорода с хлором? (Реакция соединения)
3. дайте определение понятию «реакция замещения»?(Это реакции, в ходе которых атомы простого вещества замещают атомы одного из элементов в сложном веществе)
4. Как называется соединение, образующееся при взаимодействии водорода с хлором?(Хлороводород)
4.Этап подготовки к восприятию нового материала.
Все вы читали сказки «Алиса в Стране Чудес» и «Алиса в Зазеркалье». Сегодня я предлагаю вам послушать и даже поучаствовать в необычной сказке, которая называется «Алиса на уроке химии».
Алиса была очень любопытной девочкой. И она очень любила ходить в школу. На одном из уроков химии учитель предложит ей исследовать несколько веществ. И показал ей их. Это были склянки с жидкими прозрачными веществами. На всех сосудах были этикетки с подписями веществ. Вот что на них было написано:
HCl HNO3 H3PO4 H2SO4
Алиса очень заинтересовалась тем что находиться в этих склянках. Таких формул она до сих пор не встречала. Листая учебник девочка ничего в нем подходящего не нашла.
Давайте поможем Алисе получить хорошую отметку по предмету. Сталкивались ли в раньше с такими веществами? А может вы знаете, что это такое? Я вам подскажу.
Посмотрите внимательно на мой стол (на столе лежит яблоко, лимон, аскорбиновая кислота). Как вы думаете, что общего между этими предметами и каким образом они относятся к теме нашего урока? (Ответы учеников).
- Правильно, они кислые на вкус, так как содержат кислоты. В составе яблока содержится яблочная кислота, в лимоне - лимонная. На портах у вас лежит витаминка, содержащая аскорбиновую кислоту. Скажите, когда вам можно ее пробовать? Правильно: в кабинете химии ничего нельзя пробовать на вкус! Это грубейшее нарушение правил техники безопасности. Ее вы попробуете после урока, предварительно вымыв руки.
Итак, сегодня мы будем говорить о новом классе веществ - об кислотах. И тема нашего урока: «понятие о кислотах. Понятие об индикаторах " (запись на доске и в тетради учеников) »
- Как вы думаете, какую цель мы поставим на сегодняшний урок? (Ответы учеников с записью на доске).
Я думаю, что некоторые из вас замечали, если в чай бросить кусочек лимона, то он светлеет (дем.опыт). Почему же так происходит? (Ответы учеников). Дать полный ответ на данный вопрос вы сможете в конце урока, если будете внимательно слушать.
5. Усвоение новых знаний, способов действия
Много раз, конечно, вы слышали это слово и в повседневной жизни. При приготовлении пищи используются уксусная и лимонная кислоты, в домашней аптечке есть борная кислота, в аккумуляторе автомашин заливают серную кислоту и т.д. Отметим, что и в быту, и в производственной деятельности используют в основном водные растворы кислот.
Познакомимся поближе с этими веществами.
Состав кислот
В большинстве случаев в состав молекул входят только атомы неметаллов. Перед вами представлены шаровые модели молекул некоторых кислот и их формулы.
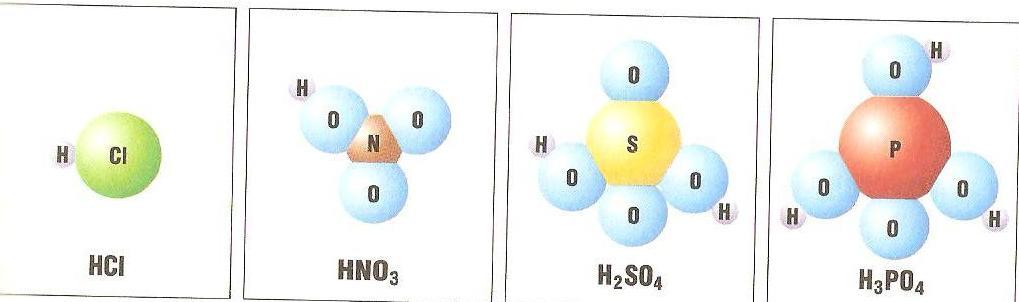
Что в формулах этих веществ общего? (Атомы водорода, стоящие на первом месте). Обратим внимание, что в состав молекулы хлороводорода, кроме атомов водорода, входит атом хлора, молекулы азотной кислоты группы атомов NO3, молекулы серной кислоты – SO4, молекулы фосфорной кислоты – РО4.
Атом хлора, группы атомов NO3, SO4, РО4, а также другие атомы группы в составе кислот называют кислотными остатками.
Давайте попробуем сформулировать определение кислот и сравнить его с определением в нашем учебнике.( ответы учащихся)
Кислоты – сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки.
Каждая кислота имеет свое название. Названия кислот приведены на стр. 134 в учебнике и эту таблицу вам надо выучить наизусть.
Давайте поможем определить Алисе, какие кислоты ей предложил изучить учитель.
А мы заполним таблицу в наших технологических картах:
| Формула кислоты | Название |
| HCl |
|
| HNO3 |
|
| H3PO4 |
|
| H2SO4 |
|
Когда Алиса разбиралась с тем, о чем ее попросил учитель она нашла в книге листок с таблицей, в которой несколько клеток были пустыми. Наверное в прошлом году такое же задание не покорилось ученику и девочка решила его тоже закончить. И мы тоже не будем отставать от нее. Вот этот листок. Таблица есть у вас в технологических картах.
| Формула | Название | Формула кислотного остатка и его валентность |
| HCl | Хлороводородная кислота | Cl (I) |
| H2SO4 | Серная кислота | SO42- (II) |
| H3PO4 | Фосфорная кислота | PO42- (III) |
| H2CO3 | Угольная кислота | CO32- (II) |
Кислотные остатки в молекулах кислот соединены с атомами водорода в соответствии со своей валентностью. Как можно ее определить?
Вы знаете, что водород всегда восстановлен. Значит, если кислотный остаток в молекуле кислоты соединен с одним атомом водорода, то его валентность равно единице, если с двумя атомами-двум, а с тремя - трем. При написании формул кислот пишут атомы водорода, а потом кислотные остатки.
- Как же выглядят кислоты? При обычных условиях кислоты существуют в жидком и твердом агрегатных состояниях. Так, фосфорная кислота при комнатной температуре - твердое вещество. При этих же условиях серная кислота - не имеющая запаха вязкая жидкость. Она почти в 2 раза тяжелее воды. Хлороводородная кислота (историческое название - соляная кислота) - раствор газа хлороводорода в воде. Раствор этой кислоты имеет характерный запах.
В большинстве случаев кислоты растворяются в воде. Исключение-кремниевая кислота. Водные растворы хлороводородной, серной и фосфорной кислот не имеют окраски. Безводная азотная кислота при хранении желтеет.
Поскольку в состав всех кислот входят атомы водорода, то кислоты обладают общими свойствами:
1) имеют кислый вкус (пробовать кислоты на вкус, как и любые другие вещества, запрещается - можно получить ожог полости рта!);
2) оказывают разъедающее действие на кожу человека, ткани, бумагу, древесину и другие материалы;
3) изменяют окраску некоторых органических веществ.
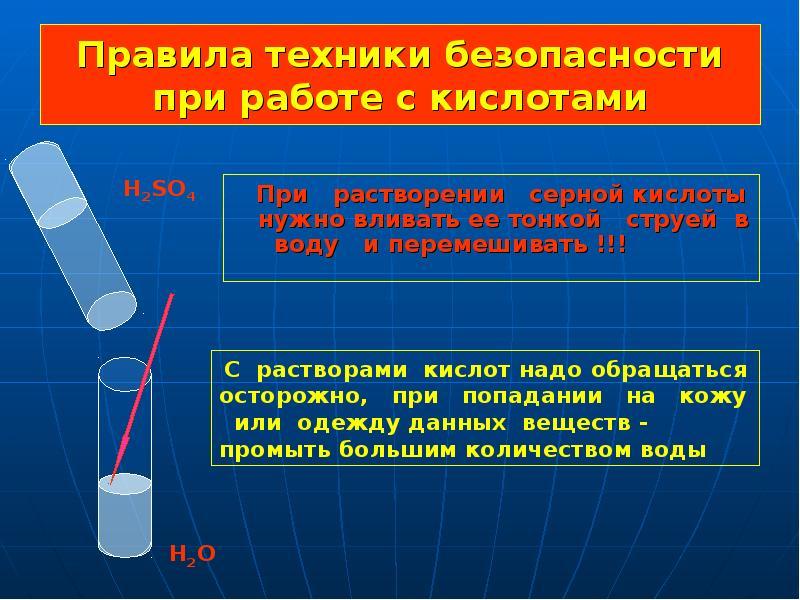
- В нашем классе тоже есть очень любознательные ученики, которые подготовили нам меры предосторожности при работе с кислотами(заслушивается сообщение Приложение).
При работе с кислотами нужно вести себя очень аккуратно. Например концентрированная серная кислота взаимодействует даже с бумагой, обугливая её. Видео!!!!! Обугливание бумаги серной кислотой. ( Приложение)
Однажды английский химик Роберт Бойль, изучая свойства соляной кислоты, закупленной в Германии в И. Глаубер, случайно пролил ее. Кислота попала на сине-фиолетовые лепестки фиалок. Через некоторое время лепестки стали ярко-красными. Это явление удивило Р. Бойля, и он тут же провел серию опытов с различными кислотами и цветами различных растений. Оказалось, что и васильки, и Роза, и цветы некоторых других растений меняли свою окраску при действии кислот.
После некоторых раздумий такие вещества Р. Бойль назвал индикаторами, что в переводе с латинского означало «указатели». Эти вещества затем стали использовать многие химики в своих опытах для распознавания кислот и оснований.
Понятие об индикаторах
Поскольку кислоты пробовать на вкус опасно, их наличие можно определить по изменению окраски специальных веществ - индикаторов.
Давайте запишем в тетради определение»индикаторов".
Индикаторы-это особые вещества, изменяющие свою окраску в присутствии кислот и ряда других веществ.
На уроках химии для обнаружения в растворах кислот используют индикаторы лакмус, метиловый оранжевый (метилоранж), а также универсальную индикаторную бумагу в виде полосок специальной бумаги, насыщенной смесью различных индикаторов. Эти вещества в растворе кислот становятся красными (правило двух ка КК - кислота красная).
6.Физкультминутка (упражнения для глаз)
А теперь отложите свои тетради в сторону, распрямите плечи, раслабьтесь и давайте с вами немного отдохнем и сделаем физкультминутку.
- Сделайте, пожалуйста, гимнастику для глаз.
Колеблющиеся движения по горизонтали справа налево и слева направо, колебательные движения по вертикали вверх – вниз, потом вниз-вверх. Круговые вращательные движения слева направо и справа налево и последнее – круговые вращательные движения в начале в правую сторону, потом в левую сторону, вычерчивая цифру 8.
7.Закрепление изученного материала
А сейчас мы закрепим наши знания и проведем лабораторный опыт «воздействие кислот на индикаторе ». Перед выполнением опыта мы должны вспомнить правила техники безопасности при работе с реактивами.
Вам для работы будут предоставлены разбавленные кислоты, которые тоже являются едкими, поэтому пробовать их на вкус тоже нельзя. Первый вариант выполняет работу с серной кислотой, а второй вариант с соляной.
Я покажу вам опыт, как кислота воздействует на универсальную индикаторную бумагу. А потом вы в своих тетрадях для практических работ запишите результаты наблюдения с соляной и серной кислотой и сделайте вывод, как с помощью индикаторов возможно обнаружить растворы кислот и отличать их от воды.
В конце учитель делает вывод: что не важно, какая кислота, индикаторы приобретают один и тот же цвет характерный именно для этого класса веществ.
8. Контроль и обобщение
- Первое знакомство с кислотами у вас произошло. На сколько продуктивным оно было, проверьте, выполнив предложенные задания:
Игра " Найди кислоты»
Данный текст, в котором среди формул различных соединений» скрыты " формулы кислот. Необходимо отыскать эти формулы.
H2О, SO2, Na2СО3, Mg, Ba, H2СО3, Ca, NaOH, H3РО4, P2О5, PH3, NaCl, CO2, HCl, K2О, Ag, H2SO4.
Следующая игра…
Игра " установи соответствие»
Установите соответствие между Формулой кислоты и ее названием.
Формула Название
а) Н3РО4 1) угольная
б) HCl 2) серная
в) Н2СО3 3) соляная
г) HNO3 4) фосфорная
д) H2SO4 5) азотная
Прием " Лови ошибку"
1.в состав кислот входят атомы кислорода и кислотные остатки (водорода).
2.индикаторы - особые вещества, которые не меняют свою окраску в присутствии кислот и некоторых других веществ (изменяют).
Тест " Проверь себя”
1. кислоты - это
а) сложные вещества, образуемые атомами металлов и кислотными остатками.
б) сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов и кислотных остатков.
в) сложные вещества, в состав которых входят атомы металлов, соединены с одной или несколькими гидроксогруппами.
2) Формула соляной кислоты:
а)H2SO4 б) Н2S в) НСI
3). Назовите эту кислоту: H2SO4
а) сернистая б) серная в) сероводородная
4. укажите цвет лакмуса в кислотах:
а) розовый б)красный в) малиновый
5. вещество, изменяющее цвет в растворах кислот, называется:
a) катализатор b) ингибитор c) индикатор
Ответы:
1-б ; 2 – в; 3 – б; 4 – б; 5 – в.
Поднимите руки те, кто не сделал ни одной ошибки. Молодцы!
Так как вы думаете, почему заварка чая светлеет, если бросить в нее кусочек лимона? (Ответы учеников). Правильно, чай выступает в роли кислотного индикатора.
9. Рефлексия
- Ну, а теперь, я предлагает вам выразить свои впечатления от нашего с вами урока.
- Я вам раздам вот такие ранцы, где с обратной стороны, вы протяните фразы…
Прием " Ранец”
Сегодня мы рассмотрели ....
Мы помогли Алисе из сказки и продолжили сказку на свой лад. Что вы запомнили с сегодняшнего урока ..
Что было самым интересным…
У меня возникли трудности, когда…
10. Информация о домашнем задании
Дам. задание §22 № 2,7 и домашний эксперимент
11. Подведение итогов урока
Выставляются оценки за урок с комментариями
Приложение
http://chemistry-chemists.com/N4_2013/ChemistryAndChemists_4_2013-P12-1.html
Список использованной литературы
Т.М. Гозман. Психолого-дидактические основания личностно-ориентированных технологий,-Барнул,:2006.
Дорно И.В. Проблемное обучение в школе. - М.: Просвещение, 1984.
Глимак И. Как стимулировать желание учиться? //Народное образование, 2003 г. №2, с.137-145
Воронцов А.Б.Практика развивающего обучения, М.:Феникс, 1999 г.
Мельникова Е.Л. Проблемное обучение, сб. «Школа – 2100», М. 1999г. №3, с.85 – 93
http://chemistry-chemists.com/N4_2013/ChemistryAndChemists_4_2013-P12-1.html
9





