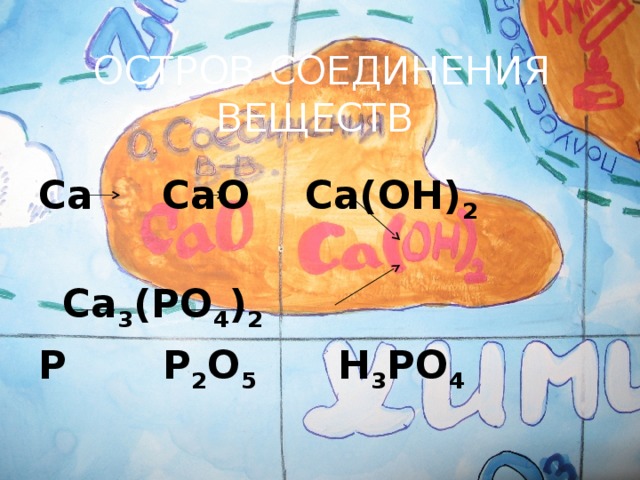Методическая разработка урока химии в 9 классе
Тема урока: «Путешествие по просторам неорганической химии»
Педагогические средства: фронтальная и индивидуальная формы оценки знаний с использованием игровой ситуации и выступлением учащихся по опорному конспекту; решение практических и расчетных задач: беседа в сочетании с самостоятельной работой, лабораторная работа, демонстрационный эксперимент.
Вид деятельности учащихся: коллективная и индивидуальная
Вид урока: урок обобщения и систематизации знаний, навыков, умений (ЗУН).
Автор: Овчинникова
Татьяна Михайловна
учитель химии и биологии
высшей категории
МБОУ «СОШ № 49»
г. Астрахань
2017 г.
Путешествие по просторам неорганической химии
ЦЕЛИ УРОКА
ОБРАЗОВАТЕЛЬНАЯ: актуализировать знания и умения учащихся по теме; научить выделять главное в понятии тип химической реакции; обратить внимание учащихся на расстановку коэффициентов в уравнении и составление формул.
РАЗВИВАЮЩАЯ: формировать умение сравнивать, переходить от частного к общему; оперировать понятиями, изученными ранее.
ВОСПИТАТЕЛЬНАЯ: убедить в необходимости умения сопоставлять химические реакции по существенным признакам; знание правил ТБ; работать в парах.
Оборудование: карта, таблицы кристаллических решеток, реактивы KMnO4, Ca, H2O, CuSO4, Fe, лучинка, штатив, пробирки, спиртовка, газоотводная трубка, спички.
ХОД УРОКА
1 Организационный момент
11 Актуализация знаний и умений ( этап путешествие)
1) Сообщение темы и цели урока (слайд № 1)
Итак, ребята мы с вами приплыли к экватору, который отделяет органическое полушарие от неорганического. В течение полутора лет мы путешествовали по неорганической химии, побывали на материках атом и простое вещество, бороздили океан, характеризующий свойства неорганических веществ. И прежде чем пересечь экватор вы должны доказать, как хорошо вы знаете неорганическую химию.
? что изучает неорганическая химия
? а из чего состоят вещества
? а молекулы (слайд №2)
2) Поэтому наша первая остановка на материке – атом. (слайд №3) Пойти к доске составить схему строения атома, электронную и графическую формулы, для элементов название, которых вы узнаете, отгадав загадки.
Тот элемент в печной трубе
Находим в виде сажи
И в простом карандаше
Его встречаем даже
Где б не встречался он в природе
Но, сгорая, всякий раз
Он образует тут же газ
Здесь речь идет об……..(углероде)
Электрон на внешнем слое
Еле держится у него
И себя не беспокоя
Отдает его тотчас
Его ножом разрезать можно
И расплавить ерунда
Будьте с ним вы осторожны
Пригодится вам тогда ( натрий)
На данных примерах мы с вами видим, что одни элементы имеют малое количество электронов на внешнем уровне и легко отдают их, проявляя + степень окисления. Другие же могут и отдавать и принимать электроны, проявляя + и – степень окисления. Поэтому все химические элементы условно разделили на две большие группы.
? Какие?
3) Отличие металлов от неметаллов заключается не только в строении атома, но и в строении простого вещества. И наша следующая остановка на материке – простое вещество. (слайд № 4)
? Какие вещества называются простыми?
? какой тип связи характерен для металлов и неметаллов?
? Какой тип кристаллической решетки у металлов и неметаллов?
А) кто пойдет к магнитной доске и соберет электронные и структурные формулы молекул водорода, кислорода и азота?
Б) определите по рисункам тип кристаллической решетки?
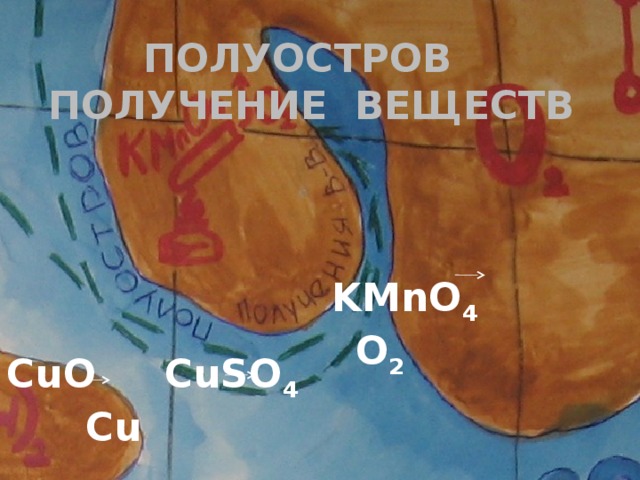
4) но не все металлы или неметаллы встречаются в природе в чистом виде, большинство из них образуют различные соединения, из которых можно их получить. Мы как раз сейчас огибаем полуостров – получение веществ. (Слайд № 5)
А) демонстрация опытов получения кислорода и меди ( ученики)
Б) составить уравнения реакций демонстрируемых опытов ( для реакций обмена составить полное и сокращенное ионное уравнения, а для ОВР указать окислитель и восстановитель)
CuO ------ CuSO4 ------- Cu
KMnO4 ----- O2
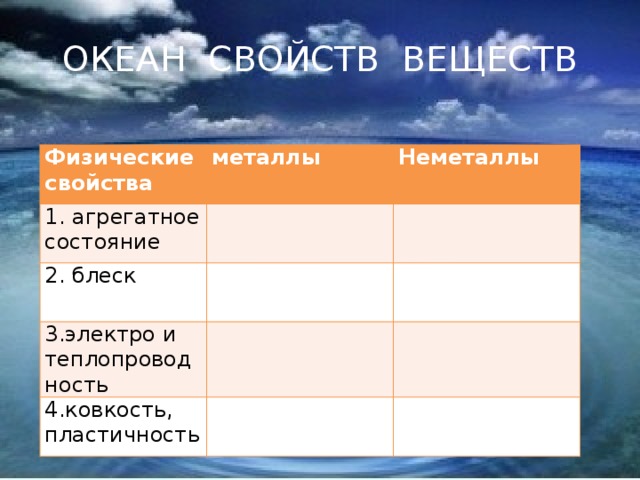
5)Чтобы попасть на остров – соединения веществ – нужно переплыть океан под названием – свойства. ( Слайд № 6)
А) на доске заполнить таблицу «сравнительные физические свойства металлов и неметаллов»
| Физические свойства | металлы | Неметаллы |
| 1. агрегатное состояние |
|
|
| 2. блеск |
|
|
| 3.электро и теплопроводность |
|
|
| 4.ковкость, пластичность |
|
|
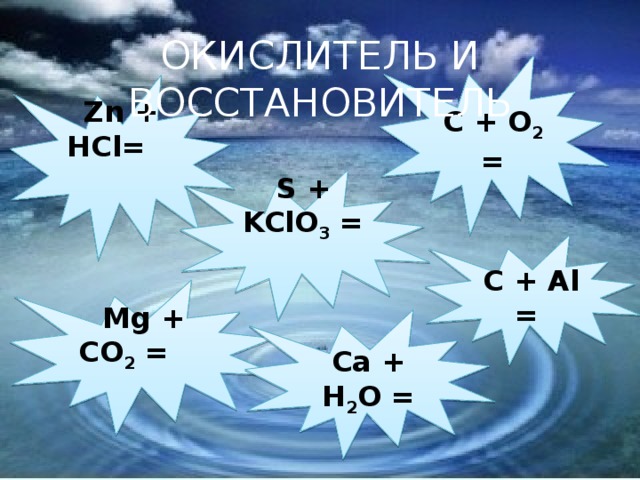
Б) работа по карточкам( закончить уравнения реакций, указать окислитель и восстановитель) ( Слайд № 7)
Zn + HCl= Mg + CO2 = C + O2 =
S + KClO3 = C + Al = Ca + H2O =
6) Наша конечная остановка остров – соединения веществ. Здесь также мы можем найти отличия металлов от неметаллов. (слайд № 8)
? Какие классы соединений вы знаете?
? Какие оксиды образуют металлы и неметаллы?
Осуществить цепочку превращений и дать названия веществам.
 Ca – CaO –Ca(OH)2
Ca – CaO –Ca(OH)2
 Ca3(PO4)2
Ca3(PO4)2
P – P2O5 – H3PO4
111 Закрепление
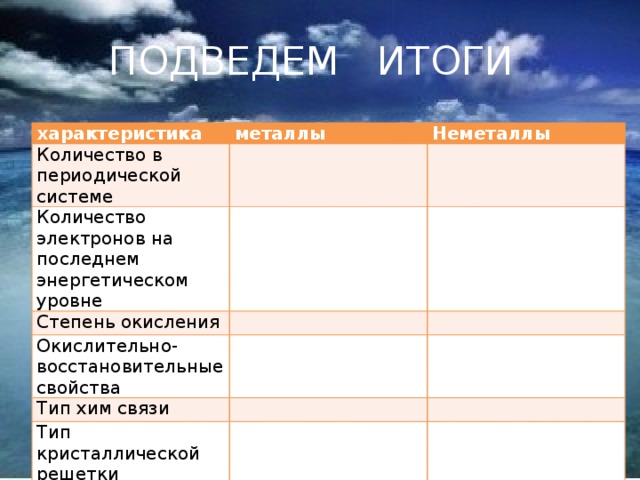
Итак наше плавание подходит к концу и в заключение заполним сравнительную таблицу металлов и неметаллов
( слайд № 9)
| характеристика | металлы | Неметаллы |
| Количество в периодической системе |
|
|
| Количество электронов на последнем энергетическом уровне |
|
|
| Степень окисления |
|
|
| Окислительно-восстановительные свойства |
|
|
| Тип хим связи |
|
|
| Тип кристаллической решетки |
|
|
| Оксиды |
|
|
Самостоятельная работа ( выполнить тест на компьютере)
( слайд № 10 и 11)
1V Итоги урока ( выставление оценок)
V Домашнее задание
Литература
1. О.С.Габриелян Химия: учебник для 9 класса общеобразовательных учреждений. М.: Просвещение,2008.
2. Исаев С.Д. Об использовании дидактических игр.// Химия в школе.//Химия в школе №6, 2002, С.50.