11 класс
Урок на тему "Электролиз растворов солей"
Цели:
Образовательная:
- Наблюдая, что происходит с расплавами и растворами солей при электролизе, научиться объяснять происходящие процессы на электродах, составлять уравнения химических реакций.
- Закрепить правила:
восстановления катионов на катоде;
окисления анионов на аноде;
- Узнать о применении электролиза в химической промышленности.
Развивающая: совершенствовать умения учащихся анализировать, сравнивать, наблюдать, делать выводы, устанавливать взаимосвязь между физическими и химическими процессами.
Воспитательная: продолжать воспитывать у учащихся культуру умственного труда, положительного отношения к знаниям и их применению в жизни.
Оборудование: персональный компьютер, интерактивная доска, диск с кинофрагментами “Химия и электрический ток”.
I. Проверка знаний домашнего задания
II. Актуализация знаний в ходе проверки основных понятий.
Учитель на интерактивной доске показывает основные понятия, которыми пользовались обучающиеся при изучении темы “Окислительно-восстановительные реакции”, и показывает основные понятия, с которыми обучающиеся будут работать в теме данного урока.
Учитель отмечает знакомые понятия (синий цвет), которые в ходе урока будут дополнены новой информацией.
| Основные понятия для темы: “Окислительно-восстановительные реакции”. | Основные понятия для темы: “Электролиз расплавов и растворов солей”. |
| - Окислительно-восстановительные реакции | - Электролиз - Электролизёр |
| - Электрохимический ряд напряжения металлов; | - Электрохимический ряд напряжения металлов; |
| - Катод | - Катод |
| - Анод | - Анод |
| - Катионы | - Катионы |
| - Анионы | - Анионы |
| - Процесс окисления | - Процесс окисления |
| - Процесс восстановления | - Процесс восстановления |
Как вы уже поняли, что при изучении данной темы мы будем пользоваться понятиями, которые вам уже известны по теме ОВР, дополним их новой информацией и узнаем несколько новых понятий.
III. Изучение нового материала:
Итак, ребята, на прошедшем уроке мы теоретически рассмотрели процессы, происходящие при электролизе,познакомились с такими понятиями как: электролиз, электролизер, характеристикой электродов.
Фронтальный опрос.
Дайте характеристики катоду и аноду.
Какие виды анодов вы знаете? Чем они отличаются друг от друга?
Какие частицы называются катионами и анионами?
Какие процессы называются окислением, а какие – восстановлением?
Сегодня мы подробно рассмотрим электролиз расплавов и растворов солей.
Итак, тема нашего урока:
“Электролиз. Применение электролиза”.
Давайте вспомним, как происходит электролиз расплавов солей.
Рассмотрим схему электролиза расплава бромида натрия. Учащийся записывает схему электролиза расплава на доске, остальные в тетрадях на местах.
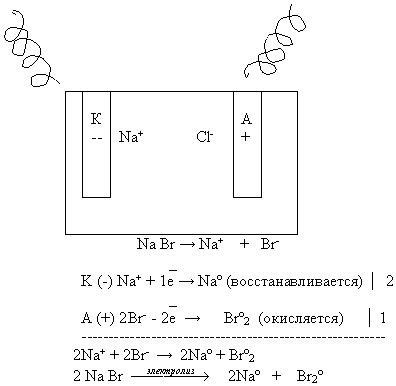
Вывод:
При электролизе расплава электролита:
На катоде восстанавливаются катионы;
На аноде окисляются анионы;
- Какие металлы можно получить электролизом расплавов солей?
(Щелочные, щелочно-земельные, алюминий – электролизом расплава оксида в криолите).
Итак, мы выяснили, какие процессы протекают при электролизе расплавов.
А теперь продолжим изучение темы и рассмотрим электролиз растворов солей.
Давайте вспомним порядок разрядки катионов и анионов на инертных электродах.
Рассмотрим электролиз раствора сульфата меди ( II)
Учитель демонстрирует видеофильм “Электролиз раствора сульфата меди (II)”.

После просмотра видеофильма учитель задает вопросы:
- Какой газ выделялся на катоде?
- Почему анод приобрел красный цвет?
- Какой раствор содержится в электролизере после окончания электролиза?

Выделение меди на аноде
В каждом химическом процессе, существуют свои закономерности (это законы Фарадея).
Опираясь на эти правила, запишем схему электролиза раствора сульфата меди (II ) на доске и в тетрадях.
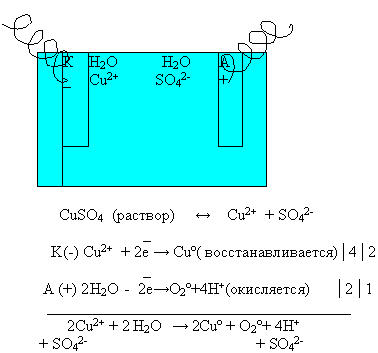
Суммарное уравнение электролиза раствора сульфата меди (II):
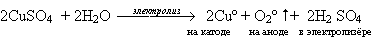
Вывод: из раствора сульфата меди( II) на катоде будут восстанавливаться катионы меди (Cu 2+), а на аноде будут окисляться ?
Какое вещество выделилось на аноде?
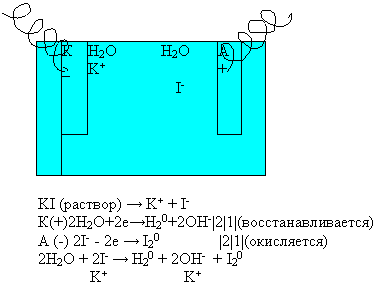
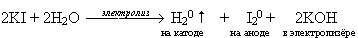
Вывод: при электролизе раствора иодида калия на катоде из молекул воды будет газы выделяются на аноде и катоде?
Какие вещества образуются в катодном и анодном пространстве?
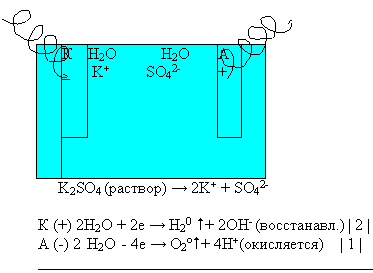
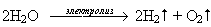
Вывод: при электролизе раствора сульфата калия электролизу подвергаются только ионы молекулы воды.
Процессы восстановления, протекающие на катоде с катионами (см по электрохимическому ряду напряжений металлов)
Процессы окисления, протекающие на аноде с анионами (см. по ряду окисления анионов).
Сообщения учащихся на тему " Применении электролиза в химической промышленности"
IV. Домашнее задание.
![]()
![]()
![]()
![]()
![]()
![]()
![]()





