Конспект урока по химии (10 класс)
Тема урока: Алкены. Строение. Изомерия. Химические свойства. Получение.
Тип урока: урок изучения и первичного закрепления нового материала.
Цели урока: создать условия для формирования знаний об алкенах как классе непредельных углеводородов, об особенностях их электронного строения и изомерии, физико-химических свойствах и способах получения.
Задачи урока:
Обучающие: изучить алкены как самостоятельный класс непредельных углеводородов, развивая знания о кратной двойной связи между атомами углерода; рассмотреть гомологию, изомерию и номенклатуру алкенов; изучить химические свойства алкенов, правило Марковникова, познакомить с промышленными и лабораторными способами получения.
Развивающие: способствовать развитию логического мышления и интеллектуальных умений (анализировать, сравнивать, устанавливать причинно-следственные связи).
Воспитательные: продолжить формирование культуры умственного труда; коммуникационных навыков: прислушиваться к чужому мнению, доказывать свою точку зрения, находить компромиссы.
Методы обучения: словесные (беседа, проблемное изложение); эвристические (письменные и устные упражнения, тестовые задания); наглядные (мультимедийное наглядное пособие).
Средства обучения: реализация внутри- и межпредметных связей, мультимедийное наглядное пособие (презентация), алгоритм решения задач и составления названий алкенов различного строения.
Технологии: элементы педагогики сотрудничества, личностно-ориентированного обучения (компетентностно-ориентированное обучение, гуманно-личностная технология, индивидуальный и дифференцированный подход), информационно-коммуникативной технологии, здоровьесберегающих образовательных технологий (организационно-педагогическая технология).
Краткое описание хода урока.
I. Организационный этап: взаимные приветствия педагога и учащихся; проверка подготовленности учащихся к уроку; организация внимания и настрой на урок.
Сообщение темы и задач изучения нового материала; показ его практической значимости. (Слайд1)
II. Проверка знаний по теме «Алканы» (2слайд)
А) Напишите формулы веществ по названию: 2-метил-бутан, 2, 3 –диметилпентан,
3-этилгептан, 2, 2, 4-триметилоктан.
Б) напишите реакцию дегидрирования этана и реакцию термического крекинга бутана
III. Изучение нового материала:
При реакции дегидрирования и крекинга алканов получилось новое вещество, относящееся к классу АЛКЕНОВ.В чем их особенность, как отличить этот класс веществ от алканов?(дети отвечают, что есть двойная связь)Алкены, или олефины, этиленовые — непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. (Слайд 3) Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общей формулой CnH2n.
Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4.
По названию первого представителя этого ряда такие углеводороды называют этиленовыми.
В алкенах атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). (Слайд 4)Вспомните все характеристики второго валентного состояния? (дети отвечают:В этом случае между углеродными атомами возникает двойная связь, состоящая из одной s- и одной p-связи. Длина и энергия двойной связи равны соответственно 0,134 нм и 610 кДж/моль. Все валентные углы 120º).
Для алкенов характерны два вида изомерии: структурная и пространственная. (Слайд 5)
Виды структурной изомерии:
изомерия углеродного скелета
 ,
,
изомерия положения двойной связи
 ,
,
межклассовая изомерия
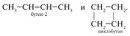 .
.
Геометрическая изомерия — один из видов пространственной изомерии. Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами, а по разную — транс-изомерами:
 .
.
По систематической номенклатуре названия алкенов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан — алкен, этан — этен, пропан — пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:
СH3
|
H3C—CH2—C—CH==CH2 H3C—C==CH—CH—CH2—CH3
| | |
CH3 CH3 CH3
3,3-диметилпентен-1 2,4-диметилгексен-2
(Слайд 6: Выполнение тестового задания № 1 для закрепления навыков составления структурных формул изомеров.)
Этиленовые обладают большей химической активностью, чем предельные углеводороды. (Слайд 7)
(Проблема: От чего зависит химическая активность алкенов?)
Химические свойства алкенов определяются двойной углерод-углеродной связью. π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента.
Для алкенов характерны реакции присоединения, окисления, полимеризации. Реакции присоединения. (Слайд 8)
Присоединение водорода (гидрирование): Н2С=СН2 + H2 → Н3С—СН3
Присоединение галогенов(хлорирование, бромирование, иодирование ит.д.): Н2С=СН2 + Cl2 → Cl−H2C—CH2−Cl
Легче идет присоединение хлора и брома, труднее — иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом. Присоединение брома к алкенам (реакция бромирования) — качественная реакция на непредельные углеводороды. При пропускании через бромную воду непредельных углеводородов желтая окраска исчезает.
Присоединение галогеноводородов: H2С=СН2 + НВr → Н3С—CH2Вr
Проблема: Как пойдёт присоединение бромоводорода к гомологам этилена несимметричного строения, например к пропилену?
(Слайд 9) Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова: при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода при двойной связи, а галоген — к менее гидрогенизированному.
СН3−HСδ+=Сδ−Н2 + Н+Вr − → Н3С—CHВr−СН3
.
Правило Марковникова соблюдается при присоединении к несимметричным алкенам и других электрофильных реагентов (H2O, H2SО4, НСl и др.).
Присоединение воды (реакция гидратации):
H3C—CH=CH2 + H—OH → H3C—CH—CH3
|
OH
Реакции окисления. (Слайд 10) Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения реакции.
Горение: Н2С=СН2 + 3O2 → 2СO2 + 2Н2O
При действии на этилен водного раствора КМnO4 (при нормальных условиях) происходит образование двухатомного спирта — этиленгликоля:
3H2C=CH2 + 2KMnO4 + 4H2O → 3HOCH2—CH2OH + 2MnO2 + KOH
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
Этиленгликоль используется в качестве антифриза, из него получают волокно лавсан, взрывчатые вещества.
В более жестких условиях (окисление КМnO4 в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов: H3C—CH=CH—CH3 + 2O2 → 2H3C—COOH
Окисление этена на серебряном катализаторе дает оксид этилена:
Ag, 350°C
2Н2С=СН2 + O2 → 2Н2С—СН2
\ /
О
Из оксида этилена получают уксусный альдегид, моющие средства, лаки, пластмассы, каучуки и волокна, косметические средства.
Проблема: Могут ли молекулы этилена и его гомологи взаимодействовать друг с другом?
Реакция полимеризации. (Слайд 11)

Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.

Алкены широко используются в качестве мономеров для получения многих высокомолекулярных соединений (полимеров).
(Слайд 12: Выполнение тестового задания № 2 для отработки умений в написании уравнений химических реакций.)
В природе алкены встречаются редко. Алкены – этен, пропен и бутен – при обычных условиях (20 °С, 1 атм) – газы, от С5Н10 до С18Н36 – жидкости, высшие алкены – твердые вещества. Алкены нерастворимы в воде, хорошо растворимы в органических растворителях.
Обычно газообразные алкены выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля.(этот способ вы уже знаете)

В промышленности алкены получают дегидрированием алканов в присутствии катализатора.(этот спосо вы уже тоже знаете)

Из лабораторных способов получения можно отметить следующие:
Из галогенопроизводных алканов:
 .
.
2. Дегидратация спиртов (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или А12O3 (в таких реакциях водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродного атома (правило А.М.Зайцева):

IV. Выводы:
Алкены – непредельные углеводороды, в молекулах которых имеется одна двойная связь. Атомы углерода находятся в состоянии sp2- гибридизации. Общая формула – СnH2n. В названии алкенов используется суффикс –ен.
Для алкенов характерны: изомерия углеродной цепи, изомерия положения двойной связи, пространственная (геометрическая) и изомерия между классами.
Алкены обладают большой химической активностью. За счёт наличия π-связи алкены вступают в реакции присоединения, окисления, полимеризации.
IV. Домашнее задание: §
Составитель: учитель химии Е.В. Мысова





